Москвы
Дубровской Г.И.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии для 11 класса Гибридизация электронных орбиталей и геометрия молекул
Содержание
- 1. Презентация к уроку химии для 11 класса Гибридизация электронных орбиталей и геометрия молекул
- 2. Содержание:Ковалентная связьНасыщаемостьПоляризуемостьНаправленностьТетраедрическое направление электронных парГипотеза о гибридизации электронных орбиталей атомовГибридизация электронных орбиталейSP3 SP3 гибридизацияsp2-Гибридизацияsp-Гибридизация
- 3. Ковалентная связьКовалентная связь наиболее распространена в мире органических и неорганических веществ.И характеризуется:НасыщаемостьюПоляризуемостьюНаправленностью в пространстве
- 4. Насыщаемость ковалентной связиНасыщаемость ковалентной связи состоит в
- 5. Электроны обладают способностью самопроизвольно перераспределяться по подуровням
- 6. ПоляризуемостьПоляризуемость ковалентной связи заключается в способности молекул
- 7. Направленность ковалентной связиНаправленность ковалентной связи обусловлена тем,
- 8. Тетраэдрическое расположение электронных парЭлектронные пары, получившиеся при
- 9. Форма молекул с ковалентными связями опредеялется закономерностью:Электронные
- 10. Гипотеза о гибридизации электронных орбиталей атомовОна была
- 11. Гибридизация электронных орбиталейГибридизация электронных орбиталей- процесс их взаимодействия, приводящий к выравниванию по форме энергии
- 12. SP3 гибридизацияпроисходит при смешивании одной s- и
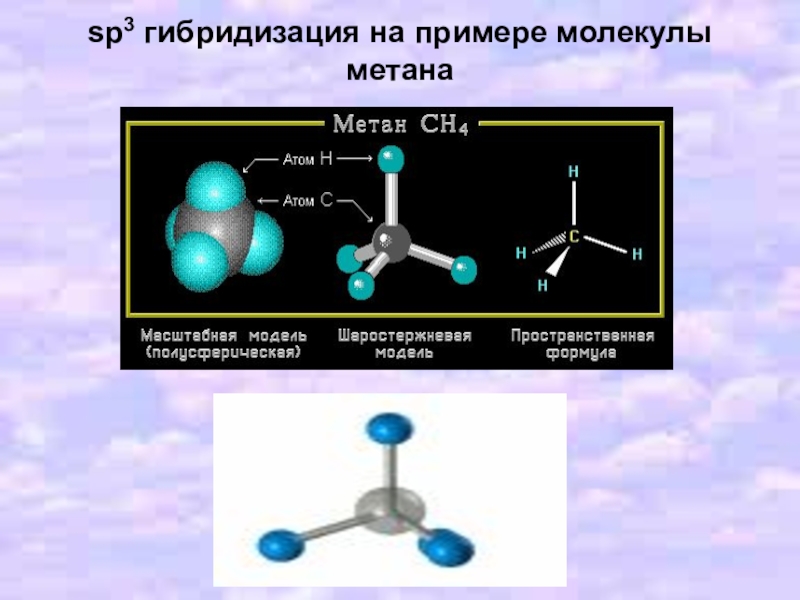
- 13. sp3 гибридизация на примере молекулы метана
- 14. sp2-Гибридизация (плоскостно-тригональная) Одна s- и две p-орбитали
- 15. sp2 гибридизация на примере этилена и формальдегида
- 16. sp-Гибридизация (линейная) происходит при смешивании одной s-
- 17. sp-гибридизация на примере ацетилена и метилацетелена
- 18. КОНЕЦ
Содержание:Ковалентная связьНасыщаемостьПоляризуемостьНаправленностьТетраедрическое направление электронных парГипотеза о гибридизации электронных орбиталей атомовГибридизация электронных орбиталейSP3 SP3 гибридизацияsp2-Гибридизацияsp-Гибридизация
Слайд 1Гибридизация электронных орбиталей и геометрия молекул
Презентация учителя химии
ГБОУ СОШ №949
ЮАО г.
Слайд 2Содержание:
Ковалентная связь
Насыщаемость
Поляризуемость
Направленность
Тетраедрическое направление электронных пар
Гипотеза о гибридизации электронных орбиталей атомов
Гибридизация электронных
орбиталей
SP3 SP3 гибридизация
sp2-Гибридизация
sp-Гибридизация
SP3 SP3 гибридизация
sp2-Гибридизация
sp-Гибридизация
Слайд 3Ковалентная связь
Ковалентная связь наиболее распространена в мире органических и неорганических веществ.И
характеризуется:
Насыщаемостью
Поляризуемостью
Направленностью в пространстве
Насыщаемостью
Поляризуемостью
Направленностью в пространстве
Слайд 4Насыщаемость ковалентной связи
Насыщаемость ковалентной связи состоит в том, что число общих
электронных пар, которые способен образовывать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав.
Слайд 5Электроны обладают способностью самопроизвольно перераспределяться по подуровням в пределах одного энергетического
уровня (без изменения главного квантового числа).
Из четырёх валентных электронов неспаренными являются два и валентность углерода в данном случае равна двум.
Теперь все четыре валентных электрона распарены, и валентность углерода равна четырем.
Слайд 6Поляризуемость
Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в
них) изменять свою полярность под действием электрического поля.
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы-превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы-превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов
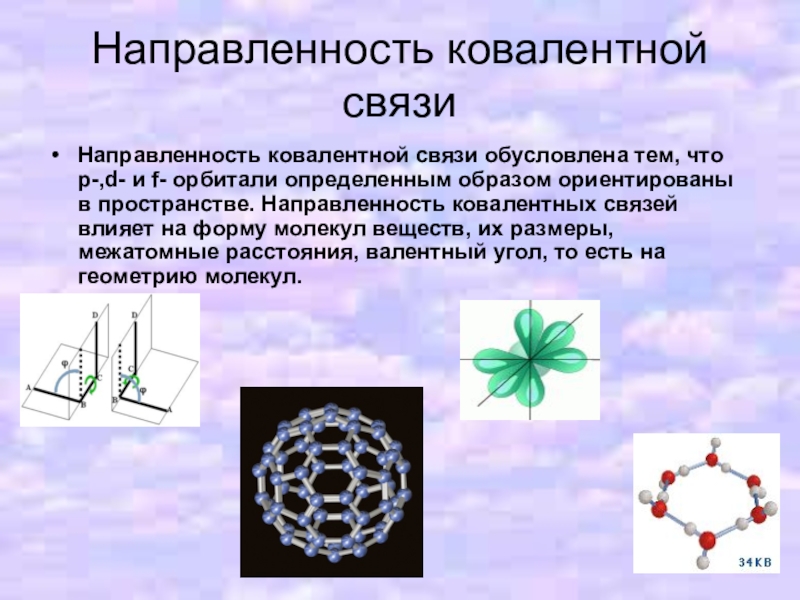
Слайд 7Направленность ковалентной связи
Направленность ковалентной связи обусловлена тем, что p-,d- и f-
орбитали определенным образом ориентированы в пространстве. Направленность ковалентных связей влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, то есть на геометрию молекул.
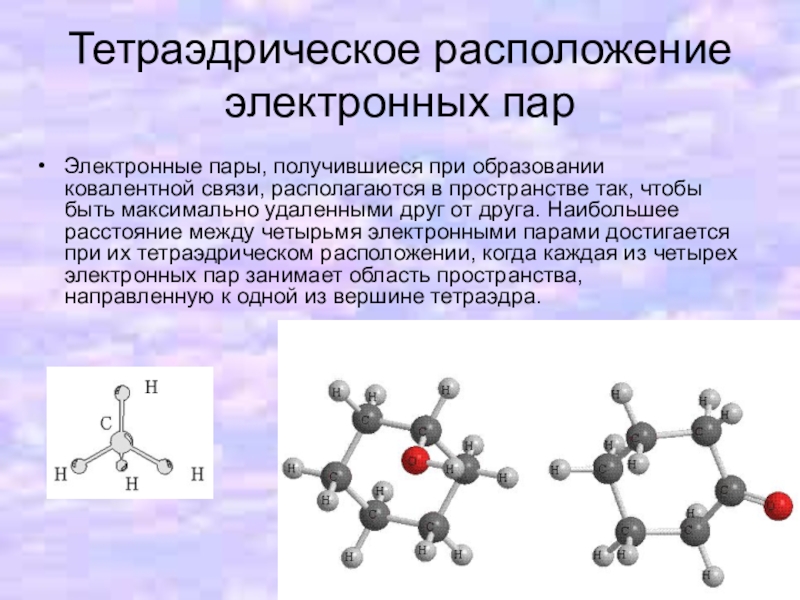
Слайд 8Тетраэдрическое расположение электронных пар
Электронные пары, получившиеся при образовании ковалентной связи, располагаются
в пространстве так, чтобы быть максимально удаленными друг от друга. Наибольшее расстояние между четырьмя электронными парами достигается при их тетраэдрическом расположении, когда каждая из четырех электронных пар занимает область пространства, направленную к одной из вершине тетраэдра.
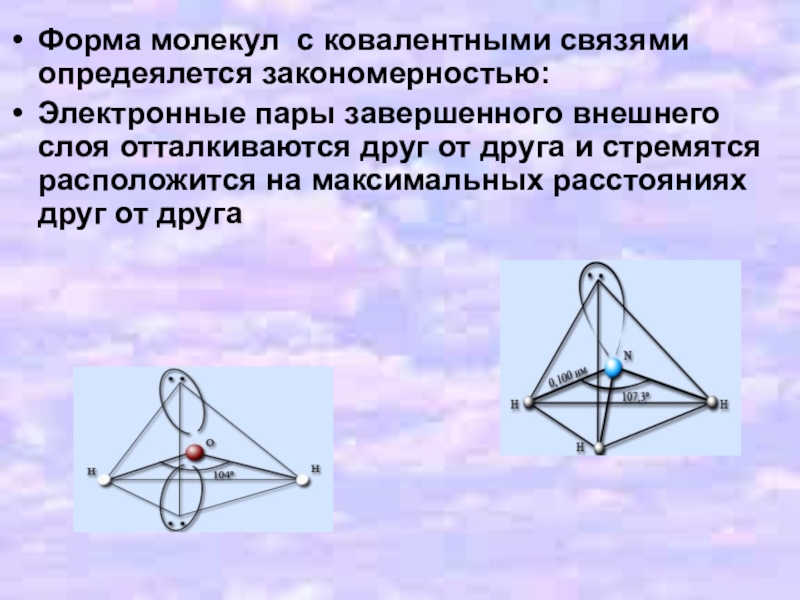
Слайд 9Форма молекул с ковалентными связями опредеялется закономерностью:
Электронные пары завершенного внешнего слоя
отталкиваются друг от друга и стремятся расположится на максимальных расстояниях друг от друга
Слайд 10Гипотеза о гибридизации электронных орбиталей атомов
Она была предположена Л. Поллингом для
объяснения установленного с помощью новых физических методов исследования веществ факта равноценности всех химических связей и сомметричного расположения их относительно центра молекул CH4, BF3, BeCl2.
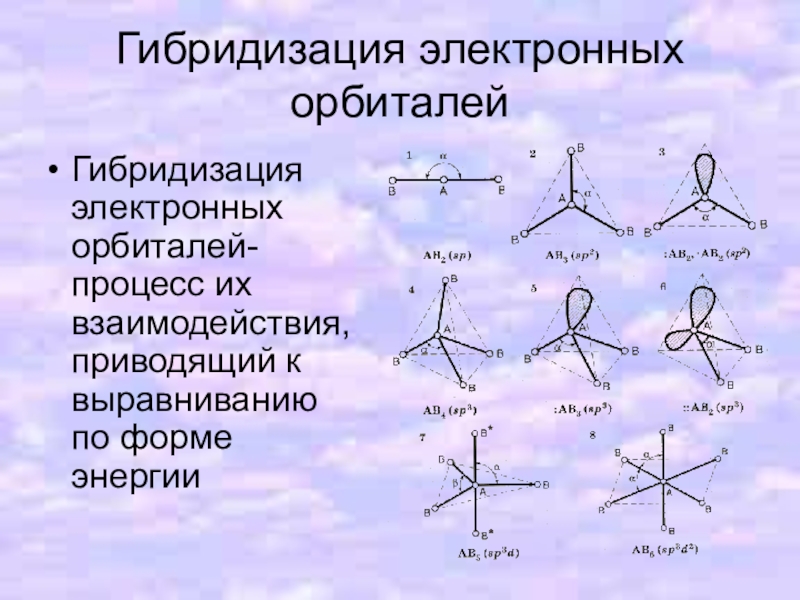
Слайд 11Гибридизация электронных орбиталей
Гибридизация электронных орбиталей- процесс их взаимодействия, приводящий к выравниванию
по форме энергии
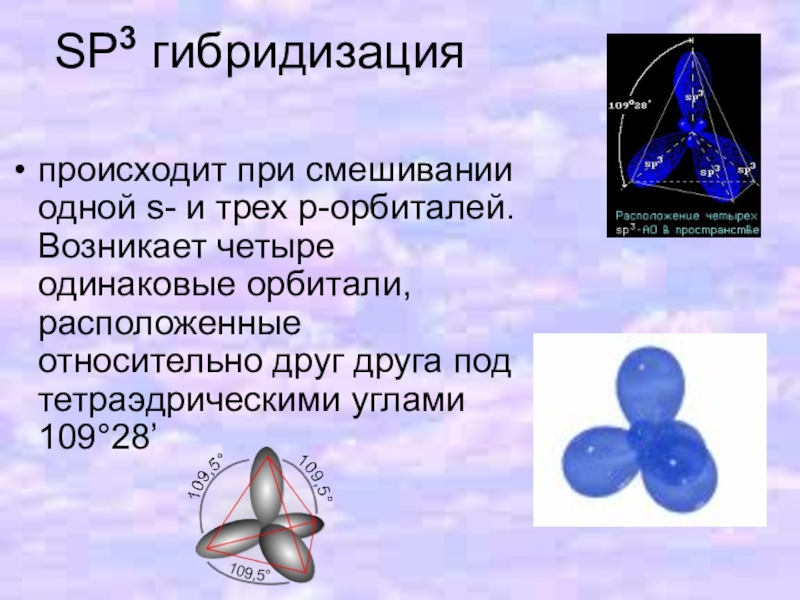
Слайд 12SP3 гибридизация
происходит при смешивании одной s- и трех p-орбиталей. Возникает четыре
одинаковые орбитали, расположенные относительно друг друга под тетраэдрическими углами 109°28’
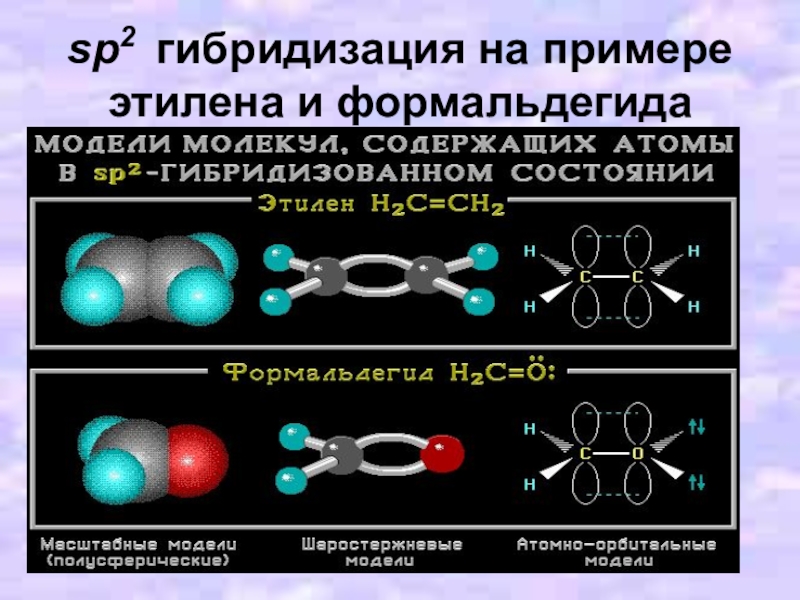
Слайд 14sp2-Гибридизация (плоскостно-тригональная)
Одна s- и две p-орбитали смешиваются, и образуются три
равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три s-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей
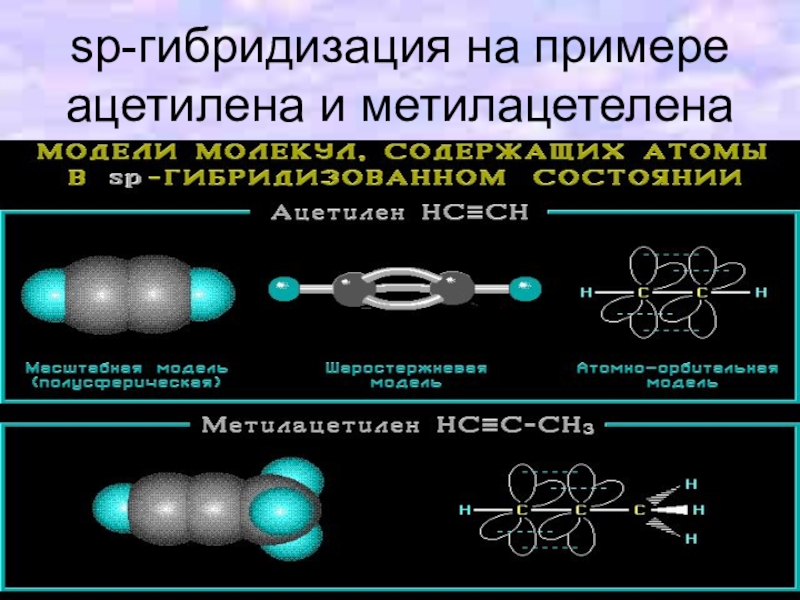
Слайд 16sp-Гибридизация (линейная)
происходит при смешивании одной s- и одной p-орбиталей. Образуется
две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны о ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях.