- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Перезентация по химии для подготовки к ОГЭ на тему Задание 22. Химические свойства простых и сложных веществ
Содержание
- 1. Перезентация по химии для подготовки к ОГЭ на тему Задание 22. Химические свойства простых и сложных веществ
- 2. ЗАДАНИЕ 1. На занятиях кружка учащиеся исследовали
- 3. ЗАДАНИЕ 2. Дана схема превращений:
- 4. ЗАДАНИЕ 3. Даны
- 5. КАК НАУЧИТЬСЯ РЕШАТЬ
- 6. АЛГОРИТМ РЕШЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ
- 7. ПОДСКАЗКИ В УСЛОВИИ
- 8. РАЗБЕРЕМ 1
- 9. 1. Химические превращения, описанные в этой задаче,
- 10. 2. Все найденные в тексте задачи подсказки,
- 11. Используя знания, без труда можно расшифровать свои
- 12. Окончательно на чистовике имеем запись: 4Р +
- 13. ЗАДАНИЕ 2. Дана схема превращений:
- 14. Cu + Cl2
- 15. Cu + Cl2
- 16. ЗАДАНИЕ 3. Даны
- 17. ЗАДАНИЕ 3. FeCl3; H2SO4(конц); Fe;
- 18. ЗАДАНИЕ 3.Fe + CuSO4 = FeSO4 +
- 19. ЗАДАНИЕ 4. В ходе лабораторной
- 20. Используемые ресурсы: https://dist-tutor.info/course/view.php?id=859&item=7306https://chem-oge.sdamgia.ru/
Слайд 1ЗАДАНИЕ 22. ОГЭ
Химические свойства простых и сложных веществ
Сарина
г. Мариинск
Слайд 2ЗАДАНИЕ 1. На занятиях кружка учащиеся исследовали простое вещество красного цвета, нерастворимое
Слайд 3ЗАДАНИЕ 2. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно
Слайд 4ЗАДАНИЕ 3. Даны вещества: FeCl3; H2SO4(конц); Fe; Cu; NaOH; CuSO4. Используя воду
Слайд 5 КАК НАУЧИТЬСЯ РЕШАТЬ ЭКСПЕРИМЕНТАЛЬНЫЕ ЗАДАЧИ? 1. Систематизировать свои знания о физических
Слайд 6 АЛГОРИТМ РЕШЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ 1. Найти в условии задачи описания химических
Слайд 7 ПОДСКАЗКИ В УСЛОВИИ 1. Подсказками служат физические свойства веществ, указанные в
Слайд 8 РАЗБЕРЕМ 1 ЗАДАНИЕ На занятиях кружка учащиеся исследовали простое вещество красного
Слайд 91. Химические превращения, описанные в этой задаче, можно выразить такими схемами
Х1 + О2 → Х2 (1)
Х2 + Н2О → Х3 (2)
Х3 + КОН → Х4 (3)
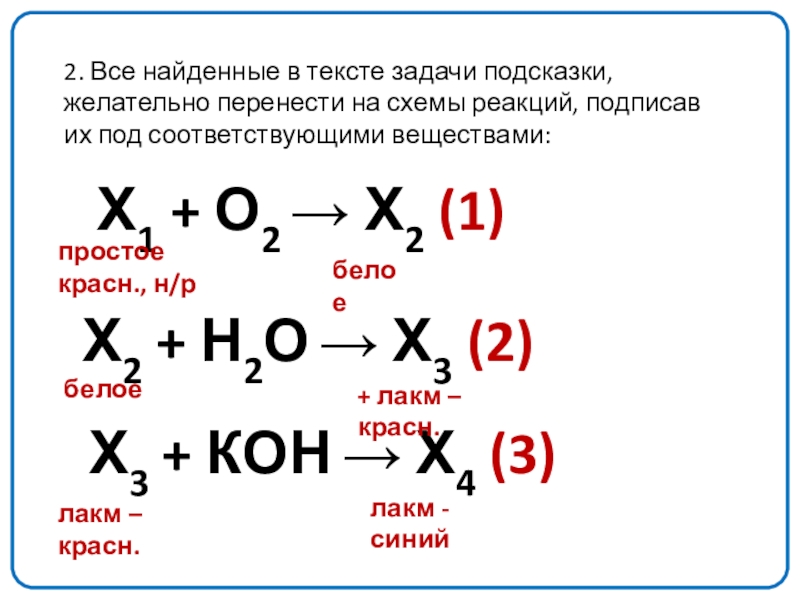
Слайд 102. Все найденные в тексте задачи подсказки, желательно перенести на схемы
Х1 + О2 → Х2 (1)
Х2 + Н2О → Х3 (2)
Х3 + КОН → Х4 (3)
простое
красн., н/р
белое
белое
+ лакм – красн.
лакм – красн.
лакм - синий
Слайд 11Используя знания, без труда можно расшифровать свои схемы. Простые вещества, красного
4Р + О2 = Р2О5 (1)
Р2О5 + 3Н2О = 2Н3РО4 (2)
Н3РО4 + 3КОН =K3PO4 + 3H2O
простое
красн., н/р
белое
белое
+ лакм – красн.
лакм – красн.
лакм - синий
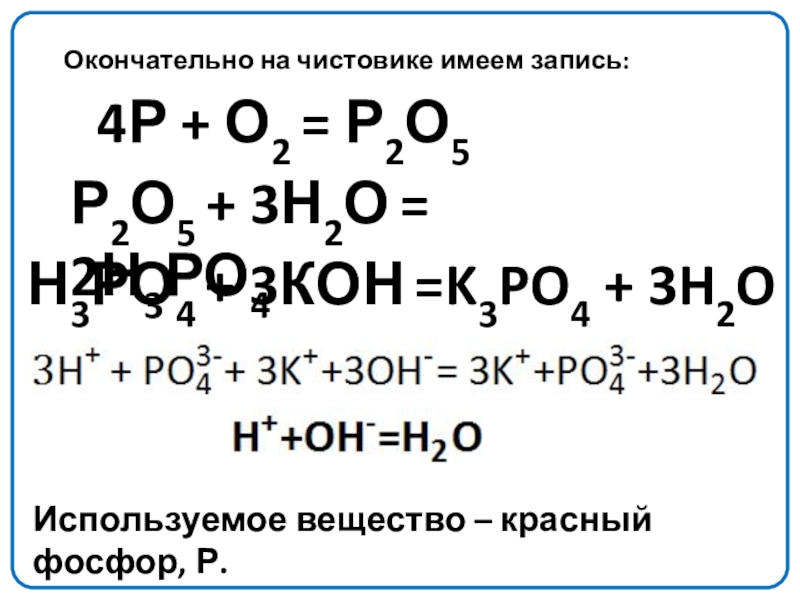
Слайд 12Окончательно на чистовике имеем запись:
4Р + О2 = Р2О5
Р2О5 +
Н3РО4 + 3КОН =K3PO4 + 3H2O
Используемое вещество – красный фосфор, Р.
Слайд 13ЗАДАНИЕ 2. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно
Слайд 14
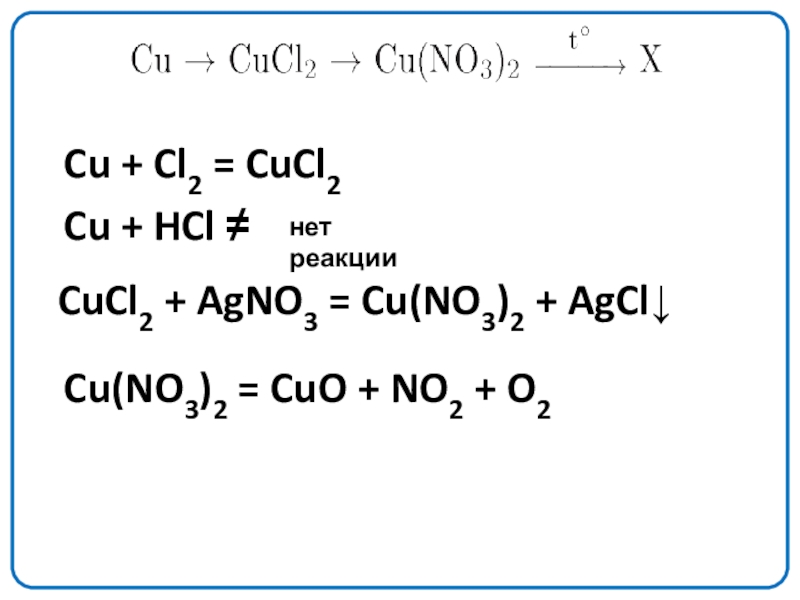
Cu + Cl2 = CuCl2
Cu + HCl ≠
нет реакции
CuCl2 + AgNO3
Cu(NO3)2 = CuO + NO2 + O2
Слайд 15
Cu + Cl2 = CuCl2
CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl↓
2Cu(NO3)2
Расставим коэффициенты в уравнениях. Составим
сокращённое ионное уравнение для второго превращения
Слайд 16ЗАДАНИЕ 3. Даны вещества: FeCl3; H2SO4(конц); Fe; Cu; NaOH; CuSO4. Используя воду
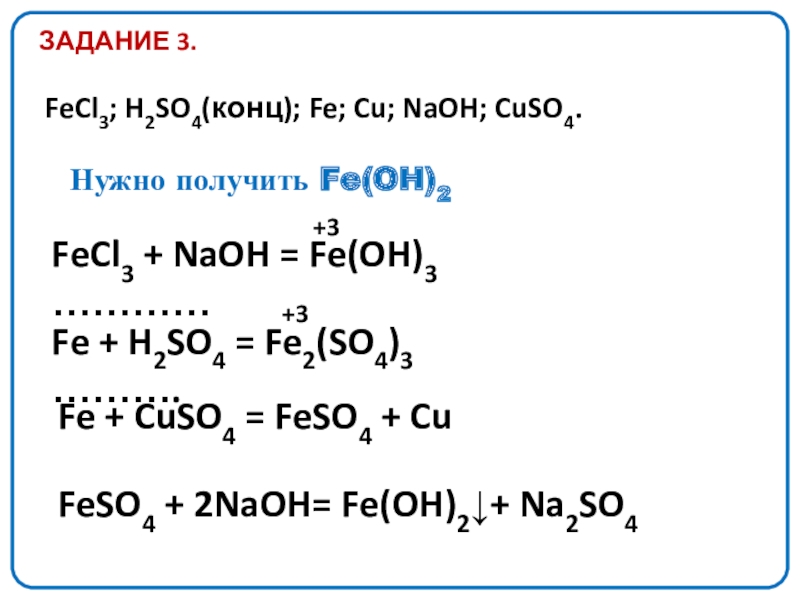
Слайд 17ЗАДАНИЕ 3.
FeCl3; H2SO4(конц); Fe; Cu; NaOH; CuSO4.
Fe + CuSO4 =
Нужно получить Fe(OH)2
FeCl3 + NaOH = Fe(OH)3 …………
Fe + H2SO4 = Fe2(SO4)3 ……….
+3
+3
FeSO4 + 2NaOH= Fe(OH)2↓+ Na2SO4
Слайд 18ЗАДАНИЕ 3.
Fe + CuSO4 = FeSO4 + Cu
FeSO4 + 2NaOH= Fe(OH)2↓+
Признаки протекания реакций:
для первой реакции: выделение красного осадка
металлической меди; изменение окраски раствора
с голубого до бледно-желтого.
2) для второй реакции: выпадение серо-зелёного осадка.
Составлено сокращённое ионное уравнение второй реакции: