- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Переодический закон и ПСХЭ Д.И. Менделеева
Содержание
- 1. Переодический закон и ПСХЭ Д.И. Менделеева
- 2. Слайд 2
- 3. Периодический закон Д.И.Менделеева был открыт в 1869г
- 4. Слайд 4
- 5. Слайд 5
- 6. Взаимосвязь положения элемента в ПСХЭ и
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. 1.Элементы одного периода имеют близкие значения атомных
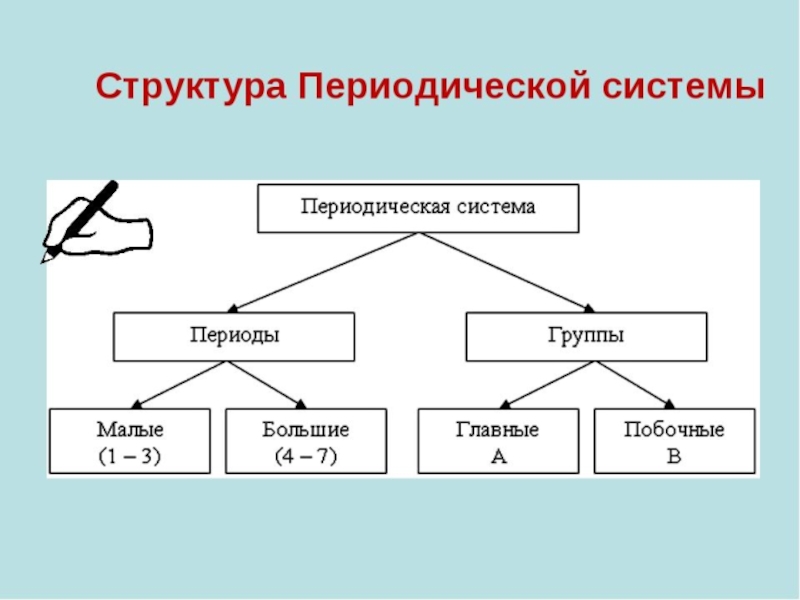
- 12. Группа периодической системы периодической системы химических элементов
- 13. Слайд 13
- 14. 1.С возрастанием заряда ядра у элементов одной
- 15. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВПО ПЕРИОДУПО ГРУППЕПо
- 16. Ме - nẽ→ Ме+n неМе +
- 17. Слайд 17
- 18. Слайд 18
Слайд 6Взаимосвязь положения элемента в ПСХЭ
и строением его атома
Порядковый номер элемента
Ar - порядковый номер = количеству нейтронов в ядре атома
Слайд 111.Элементы одного периода имеют близкие значения атомных масс, но разные физические
2.С возрастанием заряда ядра у элементов одного периода уменьшается атомный радиус. 3.Увеличивается количество валентных электронов.
4.Происходит ослабление металлических и усиление неметаллических свойств элементов.
5.Ослабление восстановительных5.Ослабление восстановительных и усиление окислительных5.Ослабление восстановительных и усиление окислительных свойств образуемых ими веществ.
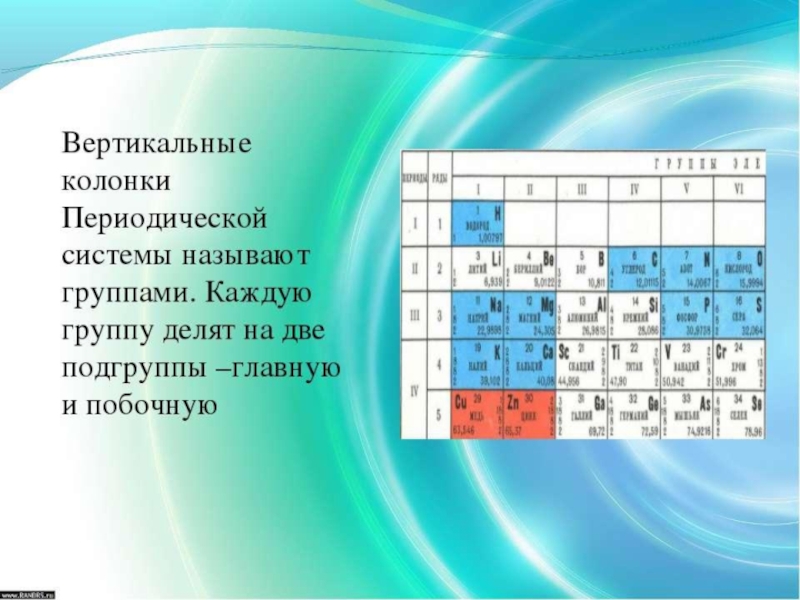
Слайд 12Группа периодической системы периодической системы химических элементов периодической системы химических элементов
Номер группы определяется количеством электроновНомер группы определяется количеством электронов на внешней оболочкеНомер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
Слайд 141.С возрастанием заряда ядра у элементов одной группы из-за увеличения числа
2.Происходит снижение электроотрицательности
3.Усиление металлических3.Усиление металлических и ослабление неметаллических свойств элементов.
4.Усиление восстановительных4.Усиление восстановительных и ослабление окислительных4.Усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Слайд 15ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПО ПЕРИОДУ
ПО ГРУППЕ
По периоду слева направо металлическая
активность
Т.к. увеличивается количество электронов
на последнем энергетическом уровне,
атому становится легче присоединить
недостающие электроны, чем отдать имеющиеся.
По группе сверху в низ металлическая
активность возрастает, а неметаллическая убывает.
Т.к. увеличивается количество энергетических
уровней, следовательно радиус атома
увеличивается,атому становится легче отдать
электроны, чем присоединить недостающие.
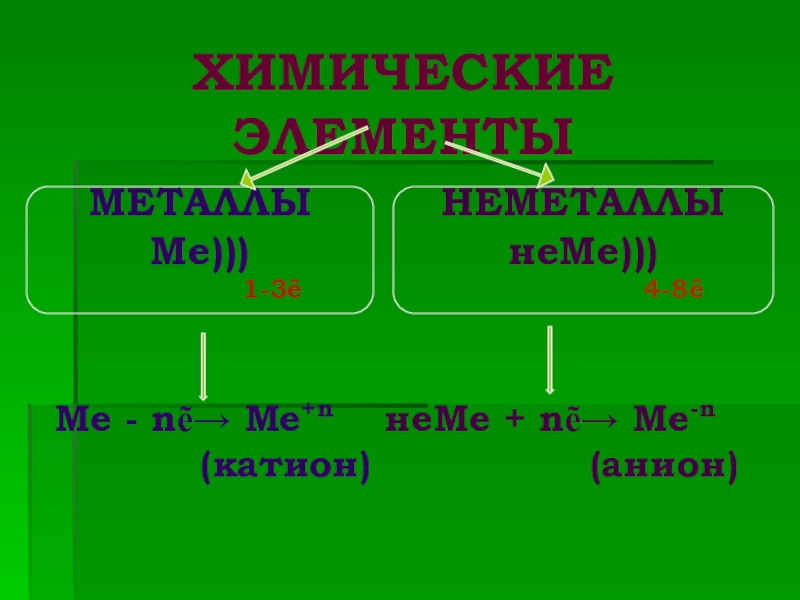
Слайд 16Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
МЕТАЛЛЫ
Ме)))
1-3ê
НЕМЕТАЛЛЫ
неМе)))
4-8ê