- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Переодическая система химических элементов
Содержание
- 1. Переодическая система химических элементов
- 2. Периодические свойства атомов. Такие свойства атомов, как
- 3. Атомы не имеют строго определенных границ, что
- 4. Радиус атома — важная его характеристика. Чем
- 5. В периоде атомный радиус в общем уменьшается
- 6. Энергия ионизации — это энергия, необходимая для
- 7. Энергия ионизации для элементов одного периода возрастает
- 8. Слайд 8
- 9. Энергия ионизации связана с химическими свойствами элементов.
- 10. Атомы могут не только отдавать, но и
- 11. Определение электроотрицательности дал американский' ученый Л. Полинг
- 12. Имеются в виду валентные электроны, т. е.
- 13. Сопоставляя значения электроотрицательностей элементов от франция (0,86)
- 14. Слайд 14
- 15. Из табл. также видно, что неметаллы характеризуются
- 16. Периодическая система химических элементов Периоди́ческая систе́ма хими́ческих
- 17. Всего предложено несколько сот вариантов изображения периодической
- 18. История открытия Д. И. Менделеев
- 19. Перед смертью мать определила Дмитрия в Педагогический
- 20. Периодическая таблица, которую Менделеев составлял с конца
- 21. Изначальная работа была озаглавлена Менделеевым как «Опыт
- 22. Немец Л. Мейер в 1864 году на
- 23. Сущность открытия заключалась в том, что с
- 24. Впоследствии стало ясно, что периодичность системы элементов
- 25. Еще немного позднее было установлено, что предложенная
Периодические свойства атомов. Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Слайд 2Периодические свойства атомов.
Такие свойства атомов, как их размер, энергия ионизации,
сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Слайд 3
Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов.
В расчетах пользуются так называемыми эффективными или кажущимися радиусами, т. е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных.
Слайд 4
Радиус атома — важная его характеристика. Чем больше атомный радиус, тем
слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее.
Слайд 5
В периоде атомный радиус в общем уменьшается слева направо. Это объясняется
ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус.
Слайд 6
Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного
электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Слайд 7
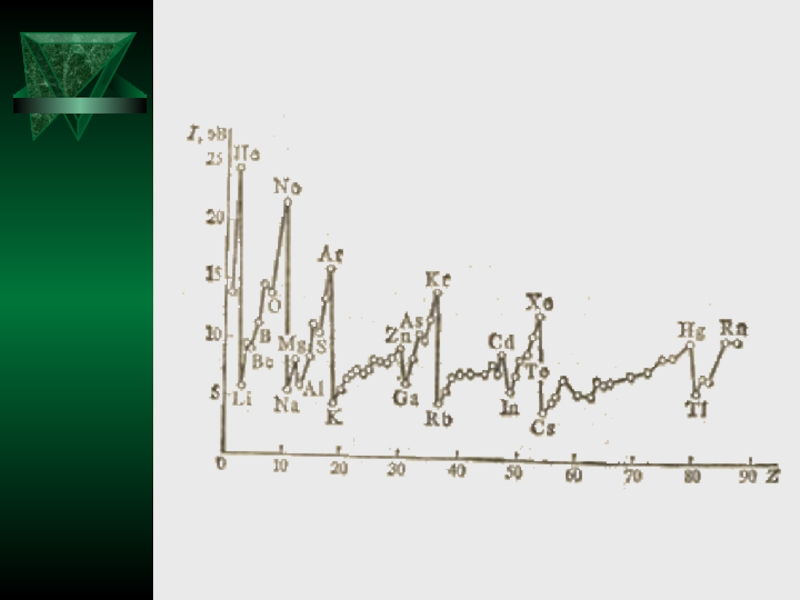
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием
заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Изменение энергии ионизации атомов с ростом заряда ядра графически представлено на рис.
Слайд 9
Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие
небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных; газов связана с их высокими j значениями энергии ионизации.
Слайд 10
Атомы могут не только отдавать, но и присоединять электроны. При этом
образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Слайд 11
Определение электроотрицательности дал американский' ученый Л. Полинг в 1932 г. Он
же предложил и первую шкалу электроотрицательности. Согласно Полингу,
электроотрицательность есть способность атома в соединении притягивать к себе электроны.
Слайд 12
Имеются в виду валентные электроны, т. е. электроны, которые участвуют в
образовании химической связи. Очевидно, у благородных газов электроотрицательность отсутствует, так как внешний уровень в их атомах завершен и устойчив.
Слайд 13
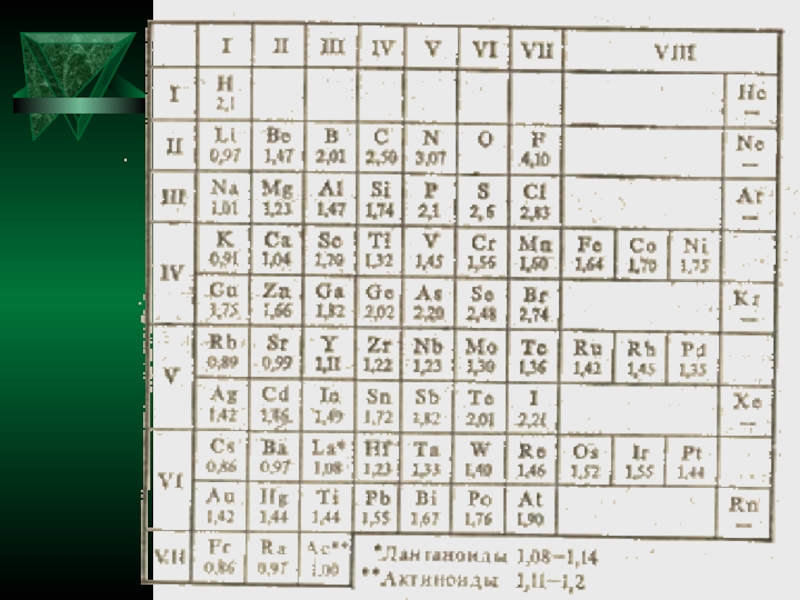
Сопоставляя значения электроотрицательностей элементов от франция (0,86) до фтора (4,10), легко
заметить, что относительная электроотрицательность подчиняется периодическому закону: в периоде она растет с увеличением номера элемента, в группе — уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства
Слайд 15
Из табл. также видно, что неметаллы характеризуются большой относительной электроотрицательностью, а
металлы — небольшой. При химическом взаимодействии элементов электроны смещаются от атома с меньшей к атому с большей относительной электроотрицательностью
Слайд 16Периодическая система химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических
элементов, устанавливающая зависимость различных свойств элементов от числа протонов в атомном ядре. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от массового числа атомов (или их атомной массы).
Слайд 17
Всего предложено несколько сот вариантов изображения периодической системы (аналитических кривых, таблиц,
геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двухмерную таблицу, в которой каждый столбец (число столбцов составляет 8) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Слайд 19Перед смертью мать определила Дмитрия в Педагогический институт в Санкт-Петербурге. Там
Менделеев получил научную степень по химии и продолжил свое обучение во Франции и Германии. В Карлсруэ он встретил итальянского химика Станислава Канниццаро (Stanislao Cannizaro, 1826–1910), чья идея о разграничении понятий атомного и молекулярного веса произвела большое впечатление на русского ученого. Вернувшись в Санкт-Петербург, Менделеев в 1864 году стал профессором химии Технологического института.
Слайд 20
Периодическая таблица, которую Менделеев составлял с конца 1860-х годов, не сразу получила
признание, но впоследствии сделала его самым известным русским ученым. В 1890 году он высказался в поддержку студентов, выступавших за социальную реформу, за что был уволен из университета. Но больше всего судьба была несправедлива к Менделееву, когда в 1906 году ему не хватило всего одного голоса для получения Нобелевской премии в области химии. Премия досталась Анри Муассану (Henri Moissan, 1852–1907), которому удалось выделить фтор — всего лишь один химический элемент, в то время как Менделеев создал классификацию их всех.
Слайд 21
Изначальная работа была озаглавлена Менделеевым как «Опыт системы элементов, основанной на
их атомном весе и химическом сходстве». По легенде, мысль о такой системе пришла к нему во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, Менделеев ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Слайд 22
Немец Л. Мейер в 1864 году на основании данных об атомных
весах предложил таблицу, показывающую соотношение атомных весов для нескольких характерных групп элементов. Многие, особенно в Германии, считают и его первооткрывателем системы — в 1870 году он опубликовал свою таблицу элементов, разработанную, по всей видимости, независимо от Менделеева. Чтобы не путаться с авторскими правами, большинство школьников мира изучают эту систему просто как «периодическую систему элементов», без упоминания имени первооткрывателя.
Слайд 23Сущность открытия заключалась в том, что с ростом атомной массы химических
элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, неон похож на аргон, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения.
Слайд 24
Впоследствии стало ясно, что периодичность системы элементов определяется не атомным весом,
а зарядом ядра или атомным номером, равным числу электронов в атоме, распределение которых по электронным оболочкам атома элемента (атомным орбиталям) определяет его химические свойства.
Слайд 25Еще немного позднее было установлено, что предложенная Д.И. Менделеевым система не
является «системой» как таковой, поскольку она, по сути дела, является лишь мнемонической схемой, позволяющей в достаточно грубом виде представить себе взаимное расположение отнюдь не всех элементов. В частности, Менделеев практически до самой своей смерти отказывался признать наличие «инертных» газов, не вписывавшихся в логику его таблицы, а также никак не мог объяснить наличие изотопов.
Но вместе с тем трудно переоценить вклад Д.И. Менделеева в развитие химии и науки вообще.
Но вместе с тем трудно переоценить вклад Д.И. Менделеева в развитие химии и науки вообще.