- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Оксиды
Содержание
- 1. Оксиды
- 2. Что такое оксиды? Оксиды – это сложные вещества,
- 3. Классификация оксидовПо агрегатному состоянию: 1) Твёрдые (Fe2O3, SiO2);2) Жидкие (Н2О, SO3);3) Газообразные (SO2, CO2);
- 4. Классификация оксидовПо химическим свойствам: 1) Несолеобразующие;2) Солеобразующие;
- 5. Несолеобразующие оксиды – такие оксиды, которые не взаимодействуют
- 6. Солеобразующие оксиды – такие оксиды, которые взаимодействуют с
- 7. Основные оксиды – это оксиды металлов в степенях окисления +1 и +2.Например:MgO соответствует Mg(OH)2Na2O соответствует NaOHBaO соответствует Ba(OH)2
- 8. Типичные реакции основных оксидов1) Основной оксид +
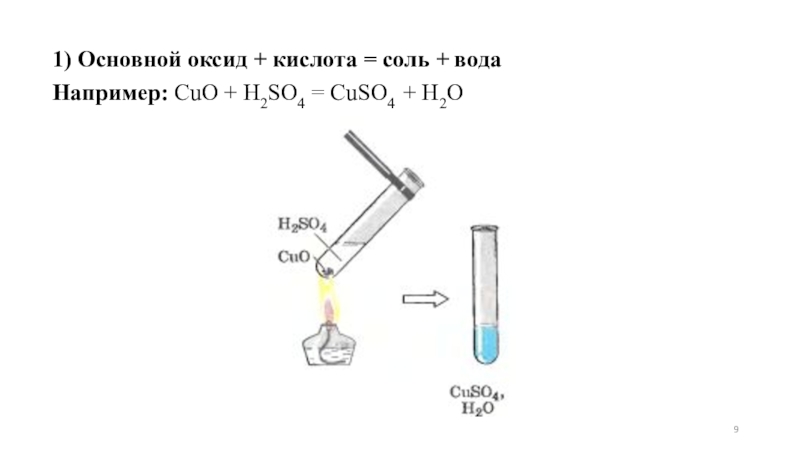
- 9. 1) Основной оксид + кислота = соль + водаНапример: CuO + H2SO4 = CuSO4 + H2O
- 10. 2) Основной оксид + кислотный оксид =
- 11. 3) Основной оксид + вода = щелочьНапример:
- 12. Кислотные оксиды — оксиды, проявляющие кислотные свойства и
- 13. Типичные реакции кислотных оксидов1) Кислотный оксид +
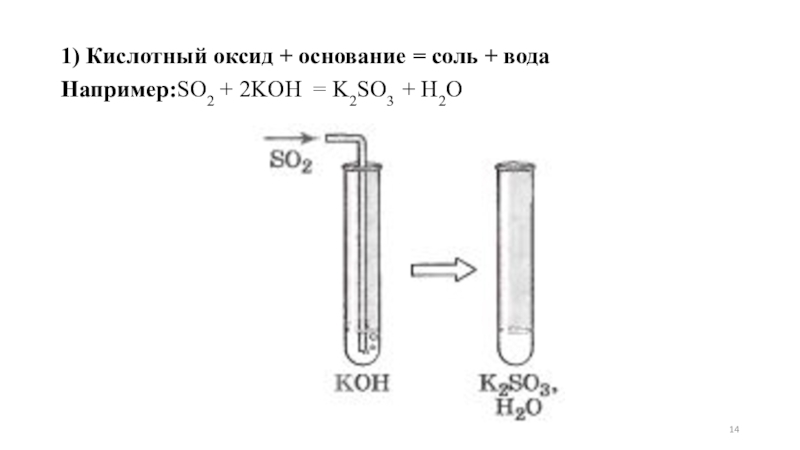
- 14. 1) Кислотный оксид + основание = соль + водаНапример:SO2 + 2KOH = K2SO3 + H2O
- 15. 2) Кислотный оксид + основной оксид =
- 16. 3) Кислотный оксид + вода = кислотаНапример:
- 17. Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от
- 18. Спасибо за внимание!
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.Один из примеров оксидов:Вода
Слайд 2Что такое оксиды?
Оксиды – это сложные вещества, состоящие из двух химических
элементов, один из которых кислород в степени окисления -2.
Один из примеров оксидов:
Один из примеров оксидов:
Вода
Слайд 3Классификация оксидов
По агрегатному состоянию:
1) Твёрдые (Fe2O3, SiO2);
2) Жидкие (Н2О, SO3);
3) Газообразные
(SO2, CO2);
Слайд 5Несолеобразующие оксиды
– такие оксиды, которые не взаимодействуют ни с кислотами, ни
с щелочами и не образуют солей.
Например:
oксиды азота (I), (II) и (IV) - N2O, NO, NO2
oксид углерода (II) – СО
oксид кремния (II) - SiO
Например:
oксиды азота (I), (II) и (IV) - N2O, NO, NO2
oксид углерода (II) – СО
oксид кремния (II) - SiO
Слайд 6Солеобразующие оксиды
– такие оксиды, которые взаимодействуют с кислотами или основаниями, образуя
при этом соль и воду.
Их виды:
Основные;
Кислотные;
Амфотерные;
Их виды:
Основные;
Кислотные;
Амфотерные;
Слайд 7Основные оксиды
– это оксиды металлов в степенях окисления +1 и +2.
Например:
MgO соответствует Mg(OH)2
Na2O
соответствует NaOH
BaO соответствует Ba(OH)2
BaO соответствует Ba(OH)2
Слайд 8Типичные реакции основных оксидов
1) Основной оксид + кислота = соль +
вода
2) Основной оксид + кислотный оксид = соль
3) Основной оксид + вода = щелочь
2) Основной оксид + кислотный оксид = соль
3) Основной оксид + вода = щелочь
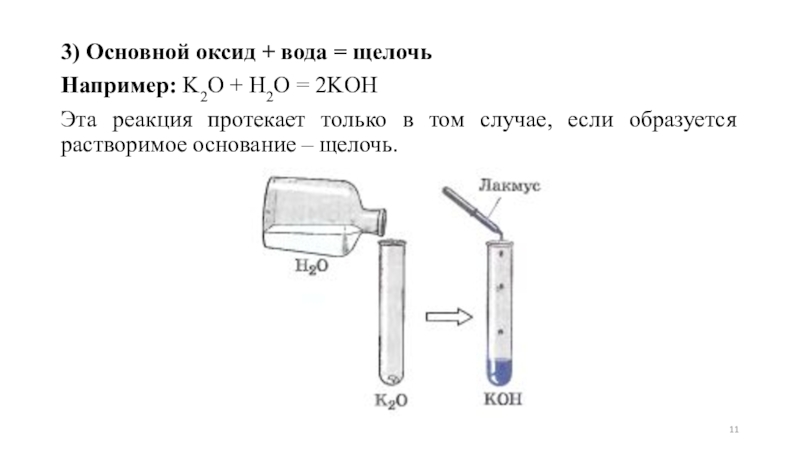
Слайд 113) Основной оксид + вода = щелочь
Например: K2O + H2O =
2KOH
Эта реакция протекает только в том случае, если образуется растворимое основание – щелочь.
Эта реакция протекает только в том случае, если образуется растворимое основание – щелочь.
Слайд 12Кислотные оксиды
— оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты.
Образованы типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных моноксидах обычно проявляют степень окисления от IV до VII.
Например:
SO3 соответствует H2SO4
CO2 соответствует H2CO3
P2O5 соответствует H3PO4
Например:
SO3 соответствует H2SO4
CO2 соответствует H2CO3
P2O5 соответствует H3PO4
Слайд 13Типичные реакции кислотных оксидов
1) Кислотный оксид + основание = соль +
вода
2) Кислотный оксид + основной оксид = соль
3) Кислотный оксид + вода = кислота
2) Кислотный оксид + основной оксид = соль
3) Кислотный оксид + вода = кислота
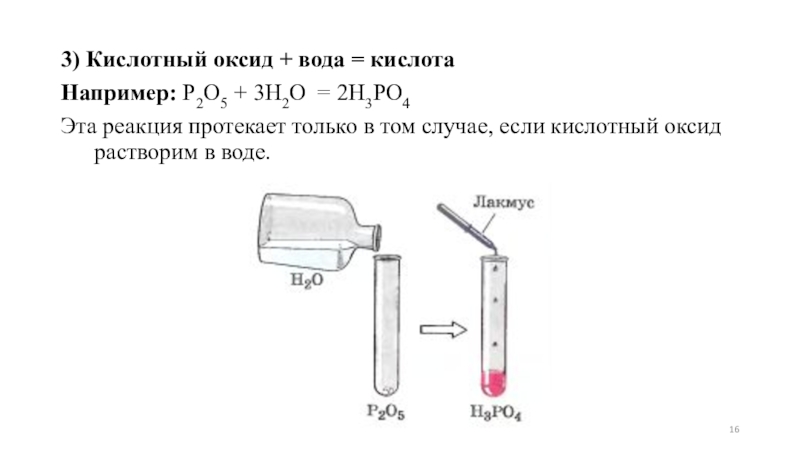
Слайд 163) Кислотный оксид + вода = кислота
Например: P2O5 + 3H2O =
2H3PO4
Эта реакция протекает только в том случае, если кислотный оксид растворим в воде.
Эта реакция протекает только в том случае, если кислотный оксид растворим в воде.
Слайд 17Амфотерные оксиды
— солеобразующие оксиды, проявляющие в зависимости от условий либо основные, либо
кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от III до IV, за исключением ZnO, BeO, SnO, PbO.