- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Оксиды
Содержание
- 1. Оксиды
- 2. ВОПРОСИТЕЛЬНЫЕ СЛОВАОСНОВНЫЕ ПОНЯТИЯ ТЕМЫГДЕ ?КАК ?ЧТО ?КАКИЕ ?ОКСИДЫФИЗИЧЕСКИЕ СВОЙСТВАХИМИЧЕСКИЕ СВОЙСТВАКЛАССИФИКАЦИЯПРИМЕНЕНИЕЭхОу
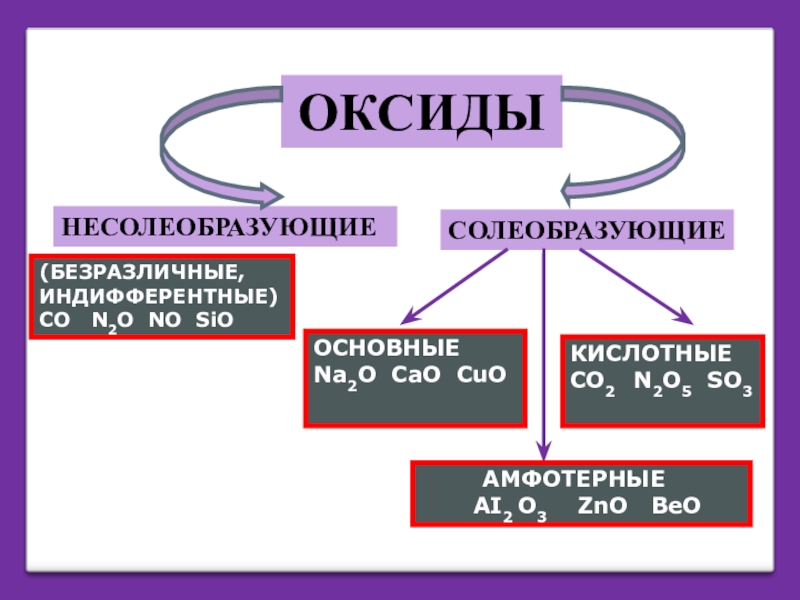
- 3. ОКСИДЫНЕСОЛЕОБРАЗУЮЩИЕСОЛЕОБРАЗУЮЩИЕ(БЕЗРАЗЛИЧНЫЕ,ИНДИФФЕРЕНТНЫЕ)СО N2O NO SiOОСНОВНЫЕNa2O CaO CuOКИСЛОТНЫЕCO2
- 4. ОКСИДЫ
- 5. ОСНОВНЫЕ ОКСИДЫОксиды, которым соответствуют основанияОксиды металлов со степенями окисления +1 и +2Оксид меди (II) CuO
- 6. КИСЛОТНЫЕ ОКСИДЫОксиды, которым соответствуют кислотыОксиды неметаллов;Оксиды металлов
- 7. АМФОТЕРНЫЕ ОКСИДЫОксиды, которым соответствуют амфотерные гидроксидыОксиды металлов
- 8. Распределите приведённые формулы оксидов по группам:К2O, Al2O3,
- 9. ТИПИЧНЫЕ РЕАКЦИИ ОСНОВНЫХ ОКСИДОВОсновный оксид +
- 10. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТНЫХ ОКСИДОВКислотный оксид + основание
- 11. Получение оксидов: 1. Взаимодействие простых веществ с
- 12. С какими из перечисленных веществ К2О, SO3,
- 13. КАКАЯ РЕАКЦИЯ ПРАКТИЧЕСКИ ОСУЩЕСТВИМА? ПОЧЕМУ?Na2O + Н2О = ?СuO + Н2О = ?
- 14. Домащнее задание:Написать мини-доклад в тетради на тему «Применение оксидов»
Слайд 2ВОПРОСИТЕЛЬНЫЕ СЛОВА
ОСНОВНЫЕ ПОНЯТИЯ ТЕМЫ
ГДЕ ?
КАК ?
ЧТО ?
КАКИЕ ?
ОКСИДЫ
ФИЗИЧЕСКИЕ СВОЙСТВА
ХИМИЧЕСКИЕ СВОЙСТВА
КЛАССИФИКАЦИЯ
ПРИМЕНЕНИЕ
ЭхОу
Слайд 3ОКСИДЫ
НЕСОЛЕОБРАЗУЮЩИЕ
СОЛЕОБРАЗУЮЩИЕ
(БЕЗРАЗЛИЧНЫЕ,
ИНДИФФЕРЕНТНЫЕ)
СО N2O NO SiO
ОСНОВНЫЕ
Na2O CaO CuO
КИСЛОТНЫЕ
CO2 N2O5 SO3
AI2 O3 ZnO BeO
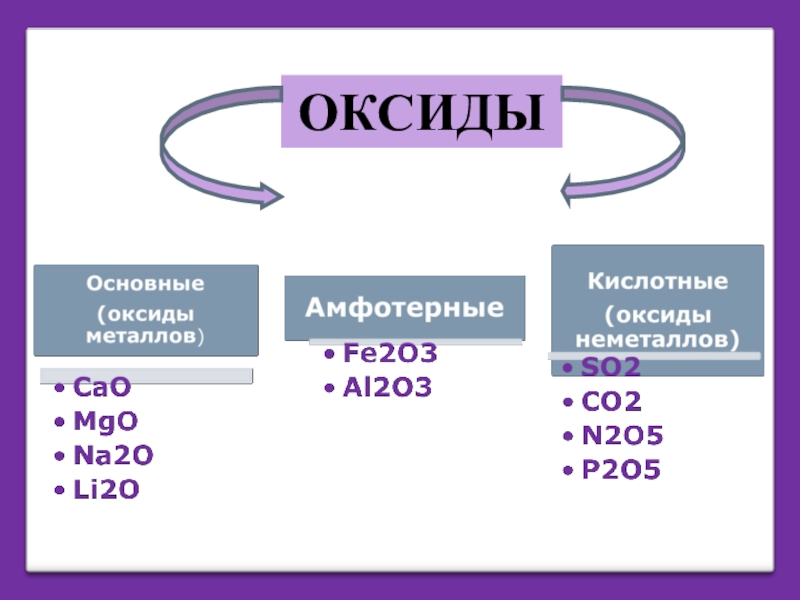
Слайд 5ОСНОВНЫЕ ОКСИДЫ
Оксиды, которым соответствуют основания
Оксиды металлов со степенями окисления +1 и
Оксид меди (II) CuO
Слайд 6КИСЛОТНЫЕ ОКСИДЫ
Оксиды, которым соответствуют кислоты
Оксиды неметаллов;
Оксиды металлов со степенями окисления +5,+6,
Оксид кремния(IV) SiO2
Слайд 7АМФОТЕРНЫЕ ОКСИДЫ
Оксиды, которым соответствуют амфотерные гидроксиды
Оксиды металлов со степенями окисления +3,
Оксид алюминия AI2O3
Слайд 8Распределите приведённые формулы оксидов по группам:
К2O, Al2O3, Сl2O7, FeO, Mn2O,
NO, CrO32, CrO, P2O5,
Mn2O7, CO, Fe2O3, Cr2O3, N2O.
Слайд 9 ТИПИЧНЫЕ РЕАКЦИИ ОСНОВНЫХ ОКСИДОВ
Основный оксид + кислота = соль +вода
CаO + 2HNO3 = Ca(NO3)2 + H2O
2. Основный оксид + кислотный оксид = соль
(реакция соединения)
CаO + N2O5 = Ca(NO3)2
3. Основный оксид + вода = щелочь
(реакция соединения)
CаO + H2O = Ca(OH)2
Слайд 10ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТНЫХ ОКСИДОВ
Кислотный оксид + основание = соль + вода
P2O5 + 6KOH = 2K3PO4 + 3H2O
2. Кислотный оксид + основный оксид = соль
(реакция соединения)
P2O5 + 3K2O = 2K3PO4
3. Кислотный оксид + вода = кислота
(реакция соединения)
P2O5 + 3Н2О = 2H3PO4
Слайд 11
Получение оксидов:
1. Взаимодействие простых веществ с кислородом.
S + O2—›
4Al + 3O2 —› 2Al2O3
2. Термическое разложение оснований, солей, кислот. CaCO3—t› CaO + CO2
2H3BO3 —t› B2O3 + H2O
Mg(OH)2 —t› MgO + H2O
3. Взаимодействие простых веществ и солей с кислотами-окислителями.
C + 4HNO3(р-р) —› СO2 + 4NO2 + H2O
Cu + 4HNO3(конц.) —› Cu(NO3)2 + 2NO2 + + 2H2O
Na2SO3 + 2H2SO4—› 2NaHSO4 + SO2 + H2O
Слайд 12С какими из перечисленных веществ
К2О, SO3, HCI, Ca(OH)2, H2O, NaCI
будет реагировать:
а) оксид лития,
б) оксид серы (IV)?