- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Oksidlanish va qaytarilish reaksiyalari
Содержание
- 1. Oksidlanish va qaytarilish reaksiyalari
- 2. Tirik
- 3. Avtomobil-sozlikdaQora metallurgiyaRanglimetallurgiyaOksidlanish-qaytarilish reaksiyalariFarmatsevtikadaYengil sanoatdaFotosintez
- 4. Qutbli kovalent va
- 5. Elеmеntlаrning оksidlаnish dаrаjаlаrini o‘zgаrishi
- 6. Oddiy moddalarda atomlarning oksidlanish darajasi 0 ga
- 7. mUrakkab Moddalar Tarkibidagi Elementlarning Oksidlanish Darajasini Aniqlash
- 8. Слайд 8
- 9. Barcha kimyoviy reaksiyalarning ikki turga bo‘lish mumkin.
- 10. Ikkinchi turga reaksiyaga kirishayotgan moddalar atomlarining oksidlanish
- 11. Слайд 11
- 12. Cu+4HNO3 Cu(NO3)2+2NO2+2H2O
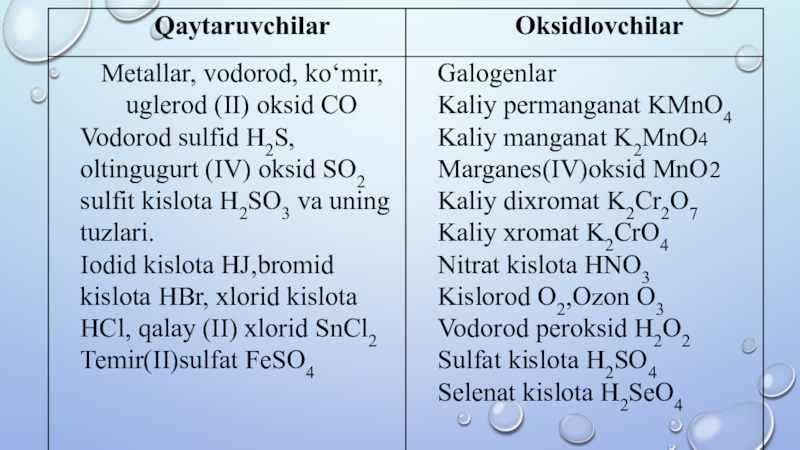
- 13. 1.Atom,molekula yoki ionning elektron berish jarayoni oksidlanish
- 14. 5.Qaytaruvchi bergan elektronlar soni oksidlovchi olgan elektronlar
- 15. Tibbiyotda dezinfeksiyalovchi vosita sifatida eng ko‘p ishlatiladigan
- 16. misol: Quyidagi oksidlanish-qaytarilish reaksiya tenglamasini elektron balans
- 17. misol: Quyidagi oksidlanish-qaytarilish reaksiya tenglamasidagi qaytaruvchining oldidagi
- 18. misol: Quyidagi oksidlanish-qaytarilish reaksiyasi tenglamasini elektron balans
- 19. Tabiatda barcha metallar korroziyaga uchraydi. Korroziyalanish deganda
- 20. Слайд 20
- 21. Elektrolizning suyuqlanmasi yoki eritmasi orqali elektr toki o‘tganida elektrodlarda sodir bo‘ladigan oksidlanish-qaytarilish jarayoni elektroliz deyiladi.
- 22. Elektroliz keng ko‘lamda qo‘llaniladi.
- 23. O‘quvchilarga darsni mustahkamlash jarayonida quyidagi misollarni berishimiz
- 24. E’tiboringiz uchun raxmat!
Слайд 1Mavzu: Oksidlanish va qaytarilish reaksiyalariGA OID MISOLLAR YECHISH
149- MAKTAB O`KITUVCHISI: BEGMALIYEVA
Слайд 2
Tirik organizmlardagi nafas olish
Tabiatdagi chirish va bijg‘ish jarayonlari
Kundalik turmushda yonish jarayonlari (gugurtning yonishi)
Tabiatda fotosintez jarayoni sodir bolishi
Akkumlyatorda kimyoviy energiya elektr energiyaga aylanishi
Sanoatda metallarning olinishi ya’ni oltin, kumush, rux, molibden, kadmiy kabi metallarni ajratib olish
Hozirgi kunda hayot faoliyatimizda, turmushda ishlatiladigan ba’zi buyumlarimiz chiroyli ko‘rinishda va korroziyaga chidamli holatda ishlab chiqarilayotganligi
Bu hodisalarning barchasi qanday kimyoviy reaksiyalarga asoslanadi?
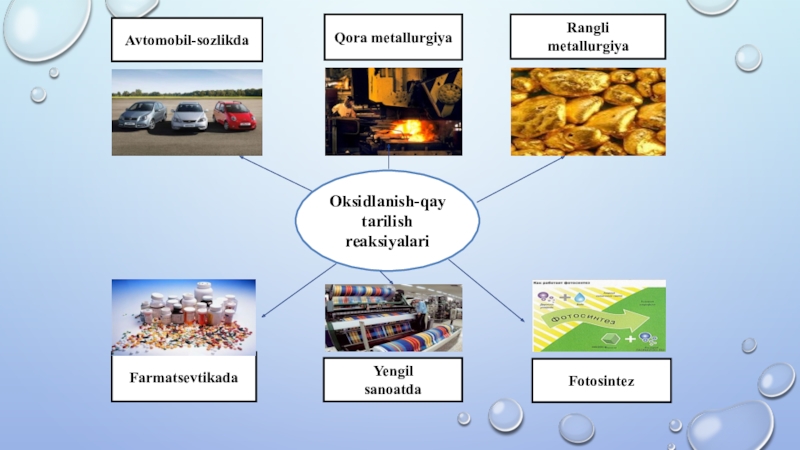
Слайд 3Avtomobil-sozlikda
Qora metallurgiya
Rangli
metallurgiya
Oksidlanish-qaytarilish reaksiyalari
Farmatsevtikada
Yengil
sanoatda
Fotosintez
Слайд 4 Qutbli kovalent va ionli birikmalar kimyoviy bog‘lanishda
1ta elektron bersa +1, olsa -1
2ta elektron bersa +2, olsa -2
Слайд 5Elеmеntlаrning оksidlаnish dаrаjаlаrini o‘zgаrishi
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8
е-оlаdi. Elеmеnt oksidlovchi ( qаytаrilаdi)
Слайд 6 Oddiy moddalarda atomlarning oksidlanish darajasi 0 ga teng (N2 , O2,
Metall atomlari barchasi elektron beradi, shuning uchun ular faqat musbat oksidlanish darajasini namoyon qiladi.
Metallmaslardan F faqat -1 oksidlanish darajasiga ega. Qolgan metallmaslar ham manfiy, ham musbat oksidlanish darajasini namoyon qiladi.
Masalan vodorod metallar bilan hosil qilgan gidridlarida -1 qolgan birikmalarda esa +1 oksidlanish darajasini hosil qiladi. Kislorod atomi esa ftorga elektron beradi va +2, qolgan birikmalarida esa -2 oksidlanish darajasini namoyon qiladi.
Слайд 9Barcha kimyoviy reaksiyalarning ikki turga bo‘lish mumkin. Ularning birinchisiga reaksiyaga kirishayotgan
H+1CL-1+K+1O-2H+1=K+1CL-1+H+12O-2
Na+1CL-1+Ag+1N+5O-23=Ag+1Cl-1+Na+1N+5O-23
Bu reaksiyalarda atomlarning har birining oksidlanish darajasi reaksiyadan oldin ham, keyin ham o‘zgarmasdan qolgan.
Слайд 10Ikkinchi turga reaksiyaga kirishayotgan moddalar atomlarining oksidlanish darajasi o‘zgaradigan reaksiyalar boradi.
Masalan:
Zn0+H+1CL-1=Zn+2Cl-1+H02
K+1CL+5O-2=2K+1CL-1+3O02
Bu
Слайд 13
1.Atom,molekula yoki ionning elektron berish jarayoni oksidlanish deyiladi.Bunda oksidlanish darajasi ortadi.
H2 0 – 2e —> 2H+
2. Elektron bergan atom molekula yoki ion qaytaruvchi deyiladi.
3.Atom, molekula yoki ionning elektron biriktirib olish jarayoni qaytarilish deyiladi.
Bunda oksidlanish darajasi kamayadi.
O20 + 4e—>2O -2 Si 0+ 4e —> Si- 4
Mn+2 +5e—>Mn+7
4.Elektron biriktirib olgan atom molekula yoki ion qaytaruvchi deyiladi.
Слайд 145.Qaytaruvchi bergan elektronlar soni oksidlovchi olgan elektronlar soniga teng.
Shunga ko’ra, oksidlanish-qaytarilish
Temirning zanglash jarayonini misol qilib olamiz.
Fe + H2O + O2—> Fe(OH)3
Oksidlanish darajasi o’zgarayotgan atomlarni aniqlab olamiz.
Fe0 + H 2O + O20 —> Fe+3(O-2H)3
Fe0-3e —> Fe+3 3 4 oksidlanish —>qaytaruvchi
O20 + 4e—> 2O-2 4 3 qaytarilish—>oksidlovchi
Demak, Fe koeffisientiga 4 , O2 koeffisientiga 3 yoziladi,qolgan atomlar shu asosda tenglashtiriladi.
4Fe + 6H2O + 3O2—> 4Fe(OH)3
Слайд 15Tibbiyotda dezinfeksiyalovchi vosita sifatida eng ko‘p ishlatiladigan modda xlorning laboratoriyada olinish
Слайд 16misol: Quyidagi oksidlanish-qaytarilish reaksiya tenglamasini elektron balans usuli bilan tenglang va
KJ-1+H2S+6O4→K2SO4+H2S-2+J02+H2O
2J-1-2e → J02 2/1/4 qaytaruvchi
S+6+8e → S-2 8/4/1 oksidlovchi
8KJ-1+5H2S+6O4→4K2SO4+H2S-2+4J02+4H2O
Oksidlovchi S elementi bo’lib, u H2SO4 tarkibida bo‘lganligi uchun uning oldidagi koeffisiyent 5ga teng bo‘ladi.
Слайд 17misol: Quyidagi oksidlanish-qaytarilish reaksiya tenglamasidagi qaytaruvchining oldidagi koeffisiyentni toping.
H2S-2+K2Cr+62O7+H2SO4→S0+Cr+32 (SO4)3 +K2SO4+H2O
S-2-2e→S0
2Cr+6+6e→2Cr+3 6/3/1 oksidlovchi
S elementi qaytarovchi bo‘lib, H2S molekulasi qaytaruvchi hisoblanadi va uning oldidagi koeffitsiyent 3 ga teng bo‘ladi.
Слайд 18misol: Quyidagi oksidlanish-qaytarilish reaksiyasi tenglamasini elektron balans usuli bilan tenglang va
KMn+7O4+NaCl-1+H2SO4→K2SO4+Mn+2SO4+Na2SO4+Cl02+H2O
Mn+7+5e→Mn+2 5/2 oksidlovchi
2Cl-1-2e→Cl02 2/5 qaytaruvchi
2KMn+7O4+10NaCl-1+8H2SO4→K2SO4+2Mn+2SO4+5Na2SO4+5Cl02+8H2O
Javob: Koeffisiyentlar yig‘indisi: 2+10+8+1+2+5+5+8=41 ga teng bo‘ladi.
Слайд 19 Tabiatda barcha metallar korroziyaga uchraydi. Korroziyalanish deganda metallarning tevarak-atrofdagi muhit ta’sirida
Слайд 21Elektrolizning suyuqlanmasi yoki eritmasi orqali elektr toki o‘tganida elektrodlarda sodir bo‘ladigan
Слайд 22 Elektroliz keng ko‘lamda qo‘llaniladi. Metall buyumlarini korroziyalanishdan muhofaza
Elektroliz texnikada, sanoatda va turmushda juda ko‘p sohalarda keng qo‘llaniladi.
Слайд 23O‘quvchilarga darsni mustahkamlash jarayonida quyidagi misollarni berishimiz mumkin:
Metallarning nitrat kislotada erish
a) Ag+HNO3→AgNO3+NO2+H2O
b) Cu+HNO3→Cu(NO3)2+H2O
d) Ca+HNO3→Ca(NO3)2+N2O+H2O
e) Mg+HNO3→Mg(NO3)2+N2+H2O
f) Mg+HNO3→Mg(NO3)2+HN4NO3+H2O
g) Fe+HNO3→Fe(NO3)2+NO2+H2O