- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему общие свойства металлов :
Содержание
- 1. общие свойства металлов :
- 2. Слайд 2
- 3. План занятия 1. Введение 2. Положение металлов
- 4. Главные особенности элементов металлов.Малое число валентных электронов
- 5. Нахождение в ПСХЭ Д.И. МенделееваГруппа
- 6. Изменение свойств в ПСХЭ Д.И. Менделеева Число
- 7. Изменение свойств в ПСХЭ Д.И. МенделееваВ периоде:Заряды
- 8. Металлы – простые вещества.Все металлы обладают общими
- 9. Электрохимический ряд напряжения металлов.Ме, стоящий в ряду
- 10. Электрохимический ряд напряжения металлов.Ме, стоящие в ряду
- 11. Электрохимический ряд напряжения металлов.На основании восстановительной способности
- 12. Взаимодействие Ме с простыми веществами.МеВзаимодействие с кислородом/оксиды,
- 13. Химические свойства металловВзаимодействие с простыми веществами
- 14. Взаимодействие Ме со сложными веществами.МеВзаимодействие с водой:чем
- 15. Взаимодействие со сложными веществами
- 16. Распространенность металлов в земной коре
- 17. Распространение металлов в организме человекаМагний – 0,03%Калий -0,23%Натрий – 0,08%Кальций – 2,08%Марганец – 0,04%Железо -0,01 %
- 18. Домашнее задание Базовый уровень. уч.
- 19. Общие свойства металлов
Слайд 1
Общие свойства металлов.
Подготовила преподаватель химии и биологии : Желяпова Светлана Васильева
СПО
Слайд 2
Слайд 3План занятия
1. Введение
2. Положение металлов в ПСХЭ.
3.Физические свойства.
4.Химические свойства.
5.Значение металлов.
Слайд 4Главные особенности элементов металлов.
Малое число валентных электронов ( [1-3] ).
Сравнительно большие
Небольшие значения электроотрицательности (от 0,7 до 1,9).
Исключительно восстановительные свойства ( - свои электроны).
Некоторые химические элементы металлы обладают двойственными свойствами (амфотерность).
Слайд 5Нахождение в ПСХЭ Д.И. Менделеева
Группа I
Период
1
2 Li B
3
4
5
6 At
7 Fr
Все элементы-
металлы:
s –; p –; d –; f -.
Элементы побочных подгрупп – металлы (переходные или d – элементы.
Слайд 6Изменение свойств в ПСХЭ Д.И. Менделеева
Число электронов на внешнем слое
Радиус атома увеличивается
Электроотрицательность уменьшается
Восстановительные свойства усиливаются
Металлические свойства усиливаются
В главной подгруппе
Слайд 7Изменение свойств в ПСХЭ Д.И. Менделеева
В периоде:
Заряды ядер увеличиваются
Радиусы атомов уменьшаются
Число
Электроотрицательность увеличивается
Восстановительные свойства уменьшаются
Металлические свойства ослабевают
Слайд 8Металлы – простые вещества.
Все металлы обладают общими физическими свойствами:
Пластичность – способность
Металлический блеск – наличие свободных электронов (наибольший у серебра)
Плотность- (самый лёгкий литий. тяжёлый –осмий)
Температура плавления- (самый лёгкоплавкий металл- ртуть, тугоплавкий –вольфрам)
Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.(самая высокая у Ag;Cu; Au; самая низкая у Мп)
Твёрдость –( самый мягкий металл Na; K; самый твёрдый –хром)
Слайд 9Электрохимический ряд напряжения металлов.
Ме, стоящий в ряду до водорода, вытесняет его
Ме, стоящий в ряду левее, вытесняет правее стоящий Ме из растворов его солей;
Слайд 10Электрохимический ряд напряжения металлов.
Ме, стоящие в ряду до Al, взаимодействуют с
остальные Ме –взаимодействуют с водой в жестких условиях с образованием оксида Ме и водорода;
Ме, стоящие в ряду за водородом, не взаимодействуют с водой;
Слайд 11Электрохимический ряд напряжения металлов.
На основании восстановительной способности Ме в ряду напряжений
от Li до Al
очень активные металлы.
Me
от Al до H2
металлы средней активности
от Н2 до Au
малоактивные металлы
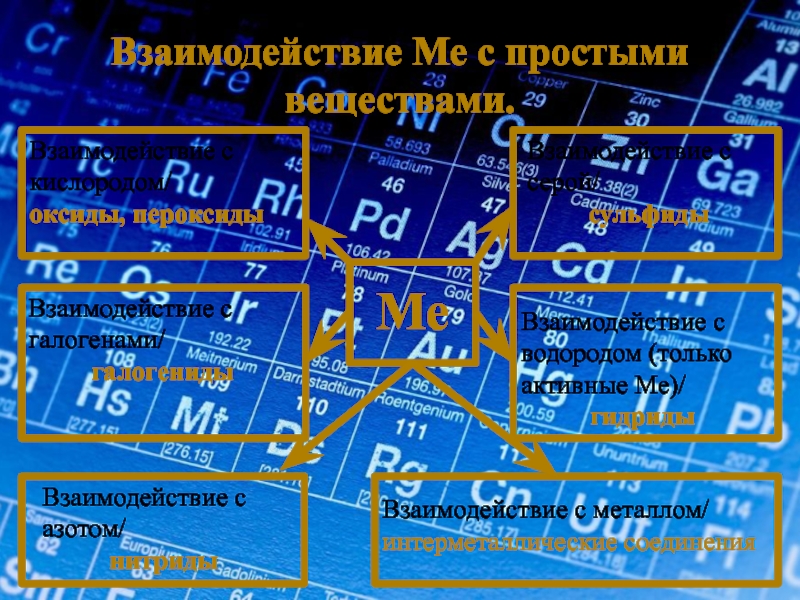
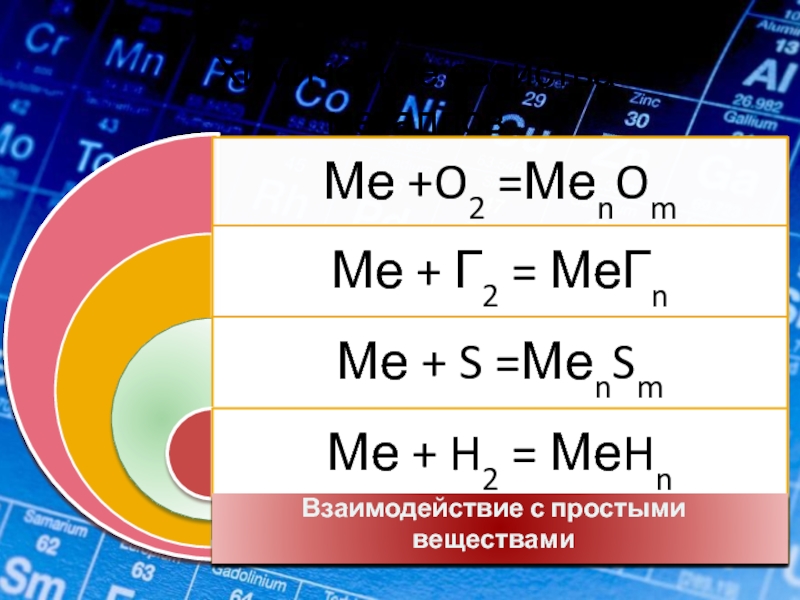
Слайд 12Взаимодействие Ме с простыми веществами.
Ме
Взаимодействие с кислородом/
оксиды, пероксиды
Взаимодействие с серой/
сульфиды
Взаимодействие с
галогениды
Взаимодействие с водородом (только активные Ме)/
гидриды
Взаимодействие с азотом/
нитриды
Взаимодействие с металлом/
интерметаллические соединения
Слайд 14Взаимодействие Ме со сложными веществами.
Ме
Взаимодействие с водой:
чем активнее Ме , тем
Гидроксиды или оксиды + водород
Взаимодействие Ме с растворами кислот:
соли +водород
Взаимодействие Ме с растворами солей:
соли активных Ме + менее активный металл
Взаимодействие Ме с органическими веществами:
органические соли
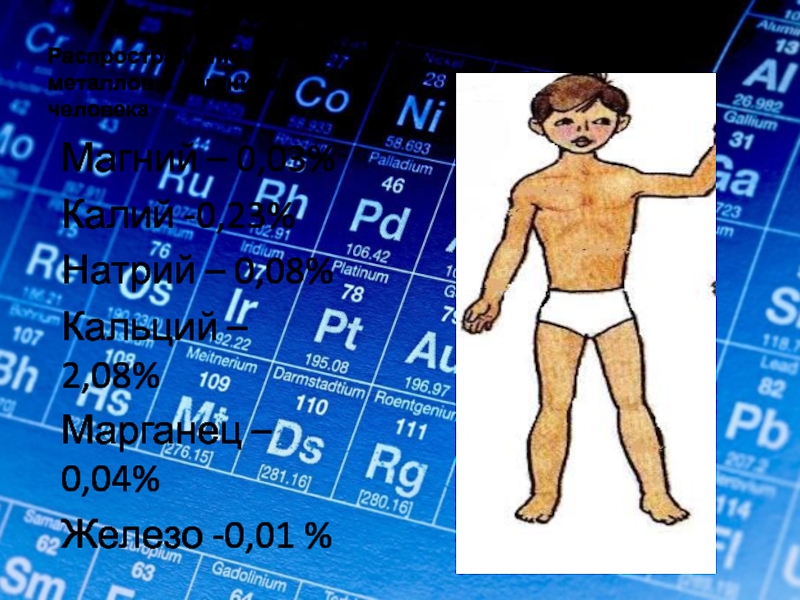
Слайд 17Распространение металлов в организме человека
Магний – 0,03%
Калий -0,23%
Натрий – 0,08%
Кальций –
Марганец – 0,04%
Железо -0,01 %



![общие свойства металлов : Главные особенности элементов металлов.Малое число валентных электронов ( [1-3] ).Сравнительно большие Главные особенности элементов металлов.Малое число валентных электронов ( [1-3] ).Сравнительно большие радиусы атомов.Небольшие значения электроотрицательности (от 0,7](/img/thumbs/9218bc957f509d6281d2a805910c81ba-800x.jpg)