- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Общие химические свойства металлов
Содержание
- 1. Общие химические свойства металлов
- 2. Расшифруйте высказывание Георга Агриколы - выдающегося немецкого
- 3. «Человек не может обойтись без металлов. Если
- 4. Цель:Систематизировать сведения о химических свойствах металловОсознать химическую функцию металлов как восстановителей
- 5. Взаимодействие калия с водой
- 6. ВзаимодействиеКальция С водой
- 7. Взаимодействие Оксида железа (III) с алюминием
- 8. Как расположены металлы в периодической системе Д.И.
- 9. Самый самый…А теперь мы будем выяснять, какой
- 10. Что характерно для атомов металлов?
- 11. Для атомов металлов характерно:Небольшое число электронов
- 12. Поэтому в химических реакциях атомы металлов отдают электроны и являются восстановителями.
- 13. На пример:Na0 - 1ē → Na+1 Al0 - 3ē → Al+3
- 14. Слайд 14
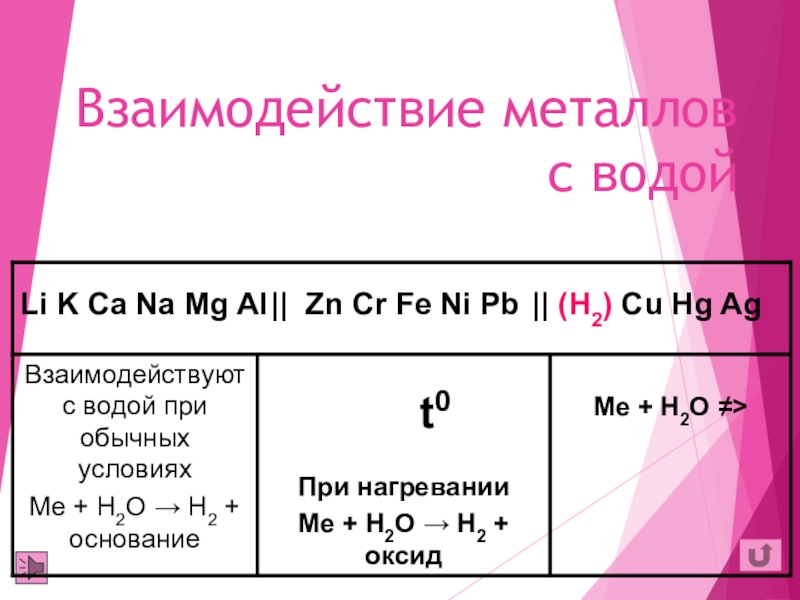
- 15. Взаимодействие металлов с водойt0
- 16. З а п о м н и!!!С водой взаимодействует только амальгамированный алюминий (лишенный оксидной пленки)
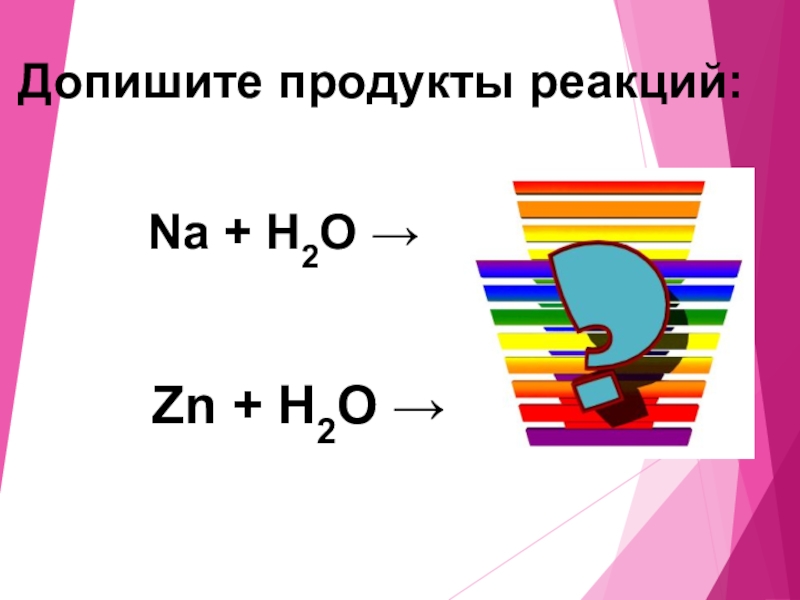
- 17. Na + H2O → Zn + H2O → Допишите продукты реакций:
- 18. Лабораторная работа №6Взаимодействие металлов с растворами кислот
- 19. Взаимодействие металлов с соляной кислотой
- 20. Zn + 2HCl → ZnCl2 + H2 ↑
- 21. Металлы могут восстанавливать и катионы менее активных металловZn0 +Cu+2Cl2 → Cu0 + Zn+2 Cl2
- 22. Все металлы на основании их восстановительной способности
- 23. Окислителями металлов являются неметаллы:Кислород, сера, галогены…
- 24. С кислородом воздуха легко взаимодействуют щелочные и щелочно-земельные металлы.4 Li0 + O20 → 2 LI+120-2
- 25. Железо, цинк, медь окисляются только при нагревании3Fe + 2O2 → Fe3O4to
- 26. Взаимодействие железа (III) с Кислородом
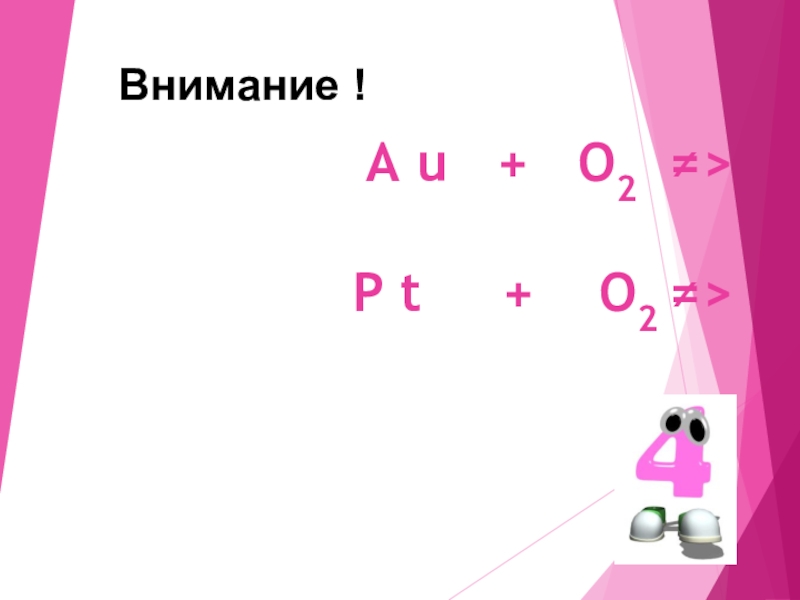
- 27. A u + O2
- 28. Металлы с неметаллами образуют бинарные соединенияХлориды – CuCl2Сульфиды – PbSФосфиды – Na3 Р
- 29. Взаимодействие меди (II) с хлором
- 30. А теперь ты должен закрепить приобретенные знания, выполнив УпражнениеУДАЧИ ТЕБЕ!!!
- 31. Если ты испытываешь трудности при выполнении этих заданий то обратись к предыдущим слайдам!
- 32. Ca + HOH → Al + HCl
- 33. 2ē Ca + 2HOH
- 34. Дома обязательно поработай с учебником!§ 32,34.Решите задачу:
Слайд 2Расшифруйте высказывание Георга Агриколы - выдающегося немецкого мыслителя XVI в., ученого-энциклопедиста,
ДАВАЙТЕ ПОИГРАЕМ…
Слайд 3«Человек не может обойтись без металлов. Если бы не было металлов,
Георг Агрикола (XVI век)
Слайд 4Цель:
Систематизировать сведения о
химических свойствах металлов
Осознать химическую функцию металлов как восстановителей
Слайд 8Как расположены металлы в периодической системе Д.И. Менделеева?
Что общего в строении
Какова сущность металлической связи?
Каковы общие физические свойства металлов? Поясните эти свойства, основываясь на представлениях о металлической связи.
Дайте определение металлам.
Вопросы
Слайд 9Самый самый…
А теперь мы будем выяснять, какой металл -- самый, самый.
1. Ковкий - (Литий, кальций, золото)
2. Тугоплавкий - (Вольфрам, магний, цинк)
3.Тяжелый – (Рубидий, цезий, осмий)
4.Тепло- и электропроводный - (Никель, серебро, свинец) 5.Твердый - (Хром, медь, марганец)
6.Легкоплавкий - (Платина, ртуть, литий)
7. Легкий - (Калий, франций, литий)
8.Блестящий - (Золото, серебро, медь)
Слайд 11Для атомов металлов характерно:
Небольшое число
электронов на внешнем слое.
С
Слайд 14 Me0
Атомам неметаллов
Катиону водорода
В составе воды
В разбавленных кислотах
Катиону менее активного металла в составе солей, оксидов
Центральному атому в составе кислородосодержащих кислот
Слайд 16З а п о м н и!!!
С водой взаимодействует
только
амальгамированный
(лишенный оксидной
пленки)
Слайд 18Лабораторная работа №6
Взаимодействие металлов с растворами кислот и солей
Оборудование и реактивы: штатив с пробирками; цинк (гранулы), железо (гвоздь), медь (проволока); растворы соляной кислоты, хлорида цинка, хлорида меди (II), сульфата железа (II).
Выполнение опыта:
В три пробирки налейте по 1 мл раствора серной кислоты и опустите в каждую пробирку по кусочку различных металлов (Zn, Fe, Сu). В каких случаях протекают химические реакции?
2. Такой же эксперимент проделайте с раствором соляной кислоты.
3. Запишите результаты опытов в таблицу "Взаимодействие металлов с кислотами":
Взаимодействие металлов с кислотами
Вывод:___________________________________________________________________________________________
4. В пробирки налейте по 1 мл растворов каждой из выданных вам солей. Опустите в пробирки по одной грануле цинка.
5. Аналогичные опыты проделайте с железом и медью.
6. Укажите, с какими растворами солей вступили в реакцию цинк, железо, медь:
Взаимодействие металлов с солями
Вывод:____________________________________________________________________________________________
Слайд 21Металлы могут восстанавливать и катионы менее активных металлов
Zn0 +Cu+2Cl2 → Cu0
Слайд 22Все металлы на основании их восстановительной
способности по отношению к ионам
в водных растворах расположены в
Электрохимический ряд напряжений металлов
Li K Ca Na Mg Al Zn Cr Fe Ni Pb H2 Cu Hg Ag
Увеличение восстановительных свойств
Слайд 24С кислородом воздуха легко
взаимодействуют щелочные и
щелочно-земельные металлы.
4 Li0 +
Слайд 28Металлы с неметаллами образуют бинарные соединения
Хлориды – CuCl2
Сульфиды – PbS
Фосфиды –
Слайд 32
Ca + HOH →
Al + HCl →
Hg + HCl
Fe + CuSO4→
5. Au + O2 →
6. Zn + O2 →
7. Fe + S →
8. Li + N2 →
Допишите практически осуществимые реакции:
Слайд 33 2ē
Ca + 2HOH →Ca(OH)2 + H2
2Al + 6HCl →2AlCl3 + H2
2ē
Fe + CuSO4 → FeSO4 +Cu
Ag + CuCl2 → не происходит
Au + O2 → не происходит
4ē
2Zn + O2 → 2ZnO
2ē
Fe + S → FeS
6ē
6Li + N2 → 2Li3N
Проверь себя!!!