- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Общая характеристика. Получение. Физические свойства. Химические свойства. Окисление спиртов. Применение.
Содержание
- 1. Общая характеристика. Получение. Физические свойства. Химические свойства. Окисление спиртов. Применение.
- 2. Слайд 2
- 3. Общая характеристика:Спиртами называются органические вещества, молекулы которых
- 4. Слайд 4
- 5. Физические свойства:Предельные одноатомные спирты от C1 до
- 6. Химические свойства:1) горение,2) взаимодействие с активными металлами;3)
- 7. Окисление спиртов:Предельные спирты, в отличие от
- 8. Применение:Метанол прекрасный
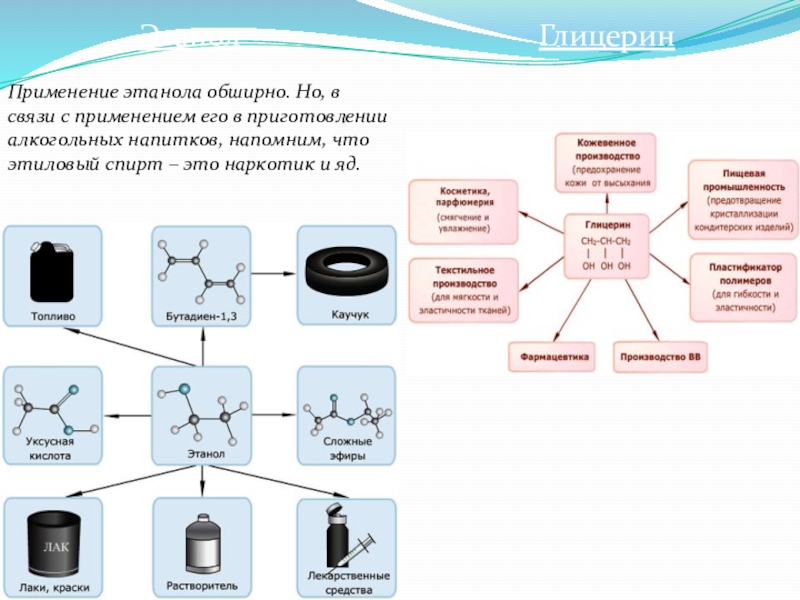
- 9. ЭтанолПрименение этанола обширно. Но, в связи с
Слайд 2
Общая характеристика.
Получение.
Физические свойства.
Химические свойства.
Окисление спиртов.
Применение.
Слайд 3Общая характеристика:
Спиртами называются органические вещества, молекулы которых содержат
одну или несколько
Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко
испаряющаяся (температура кипения 64,7 єС, температура плавления -97,8 єС, оптическая плотность 0,7930) . Спирт, содержащий 4—5 % воды , называют
ректификатом, а содержащий только доли процента воды — абсолютным спиртом.
Такой спирт получают химической обработкой в присутствии водоотнимающих
средств (например, свежепрокаленного СаО).
Слайд 4 Получение:
1) Гидратация алкенов:
Эта
Метанол в промышленности получают из “синтез-газа”- смеси газообразных оксида углерода (II) и водорода:
Этанол образуется при брожении глюкозы – разложении глюкозы под воздействием ферментов:
В промышленности:
1) получение СН3 ОН
- из синтез-газа
- во время сухой перегонки древесины (древесный спирт),
2) гидратация алкенов,
3) брожение сахаристых веществ.
В лаборатории:
1) из алканов через галогенопроизводные,
2) восстановление альдегидов.
Слайд 5Физические свойства:
Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие
Слайд 6Химические свойства:
1) горение,
2) взаимодействие с активными металлами;
3) взаимодействие с органическими кислотами,
4) с галогеноводородами;
5) окисление
- первичный спирт -> альдегид, - вторичный спирт -> кетон, - третичный спирт: тяжело окисляется с разрывом С-С связи;
6) дегидратация:
- внутримолекулярная, - межмолекулярная с образованием простых эфиров;
7) дегидратация и дегидрирование (реакция Лебедева).
Слайд 7 Окисление спиртов:
Предельные спирты, в отличие от алканов , легко окисляются.
Слайд 8 Применение:
Метанол
прекрасный растворитель,
сырье для производства
добавка к моторному топливу для увеличения октанового числа.
Этиленгликоль
Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей (различные тосолы).
В гораздо больших количествах этиленгликоль используется в производстве полимеров, которые являются основой некоторых видов пластмасс и волокон.
Слайд 9Этанол
Применение этанола обширно. Но, в связи с применением его в приготовлении
Глицерин