Этилен и его гомологи»
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Непредельные углеводород. Этилен и его гоиологи
Содержание
- 1. Непредельные углеводород. Этилен и его гоиологи
- 2. Непредельные углеводородыНепредельные или ненасыщенные углеводороды – это
- 3. Непредельные углеводородыАлкены;Алкадиены;Алкины
- 4. АлкеныОпределение алкеновИзомерияНоменклатураПолучениеХимические свойстваФизические свойстваПрименение
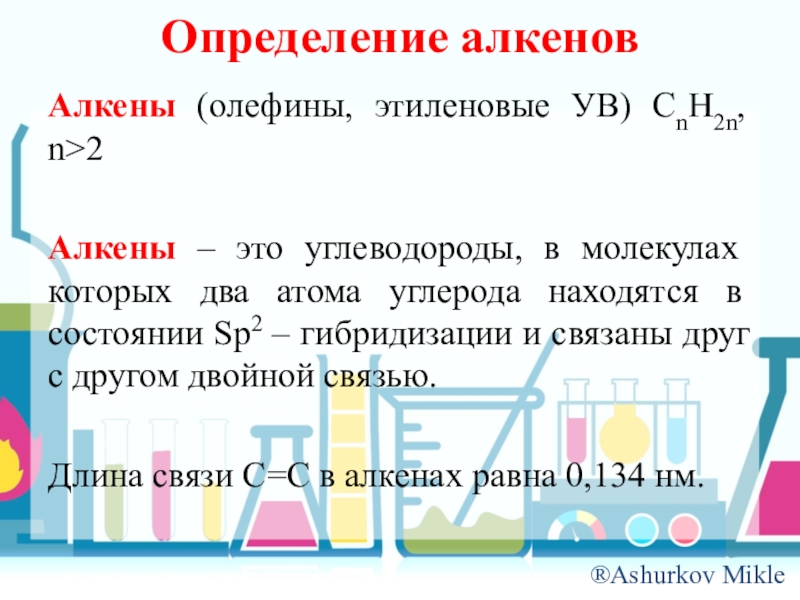
- 5. Определение алкеновАлкены (олефины, этиленовые УВ) CnH2n, n>2Алкены
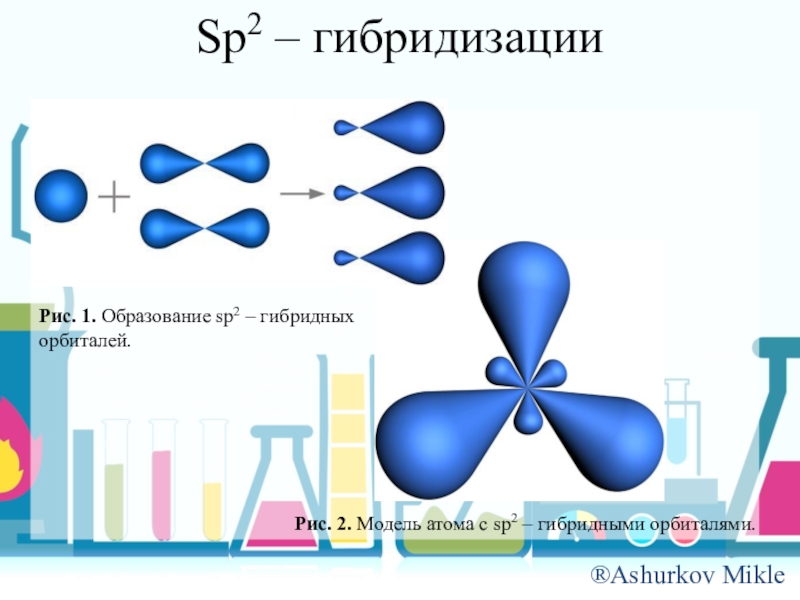
- 6. Sp2 – гибридизацииРис. 1. Образование sp2 –
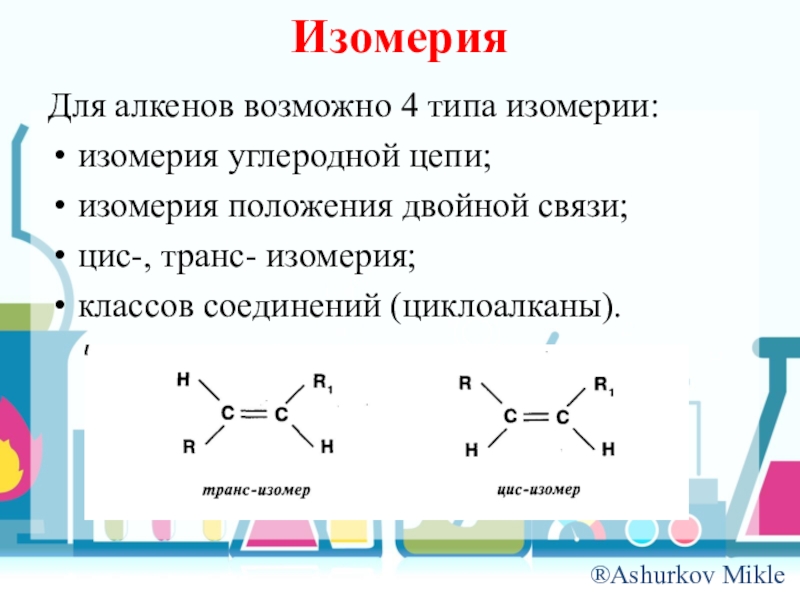
- 7. ИзомерияДля алкенов возможно 4 типа изомерии:изомерия углеродной цепи;изомерия положения двойной связи;цис-, транс- изомерия;классов соединений (циклоалканы).
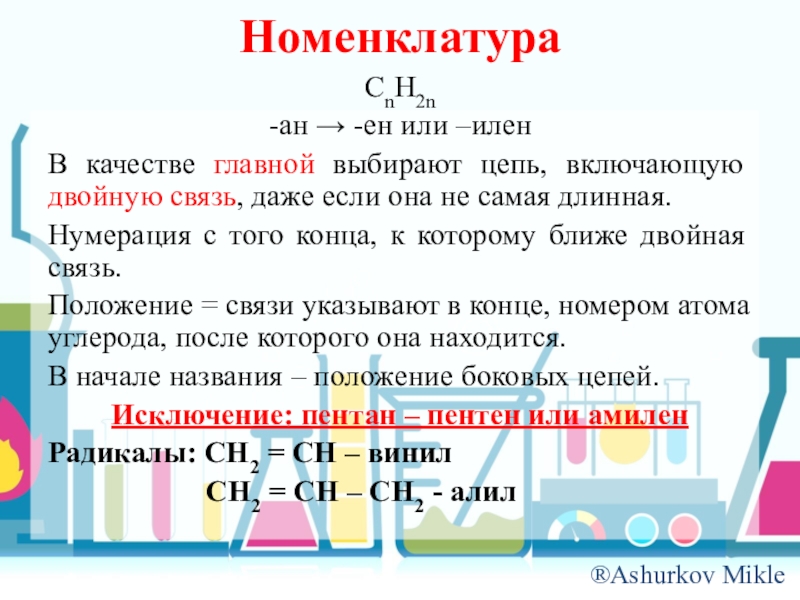
- 8. НоменклатураCnH2n-ан → -ен или –иленВ качестве главной
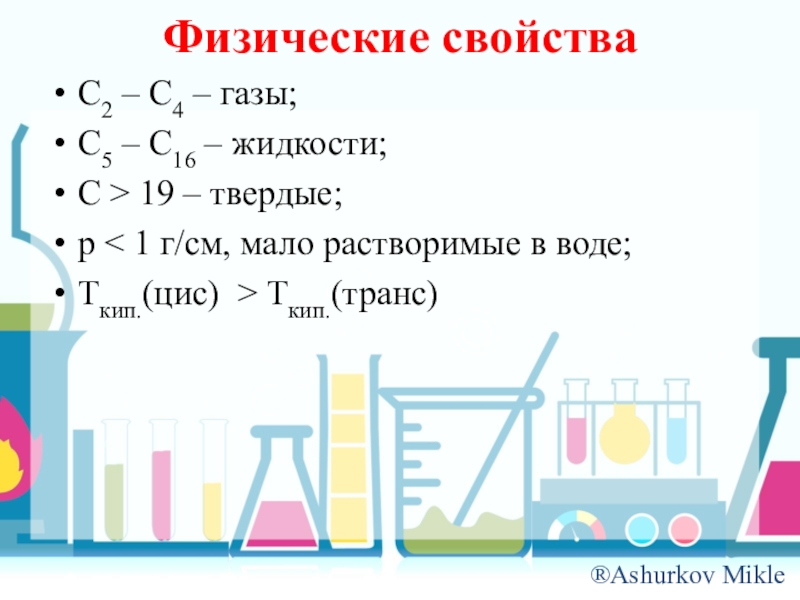
- 9. Физические свойстваC2 – C4 – газы;C5 –
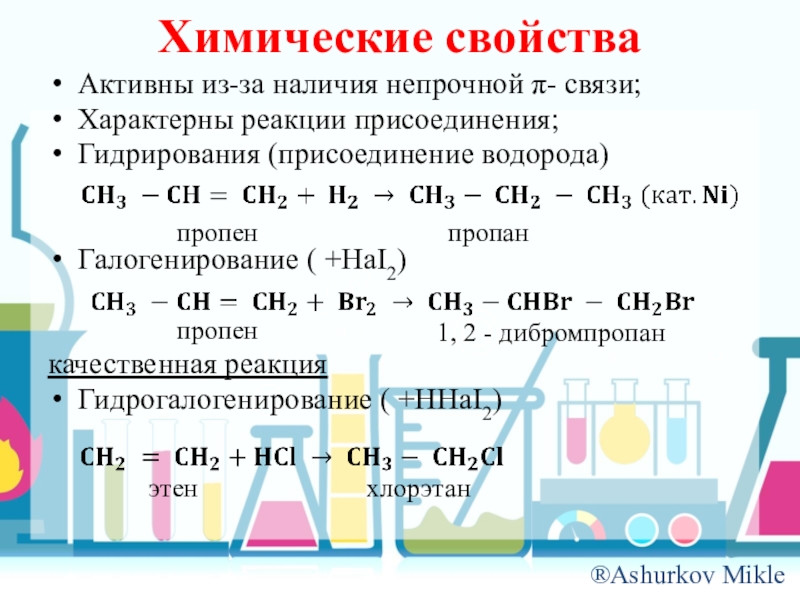
- 10. Химические свойстваАктивны из-за наличия непрочной π- связи;Характерны
- 11. История открытия этиленаНемецкий ученый Иоганн Иохим Бехер
- 12. История открытия этиленаВ 1795 году голландский химик
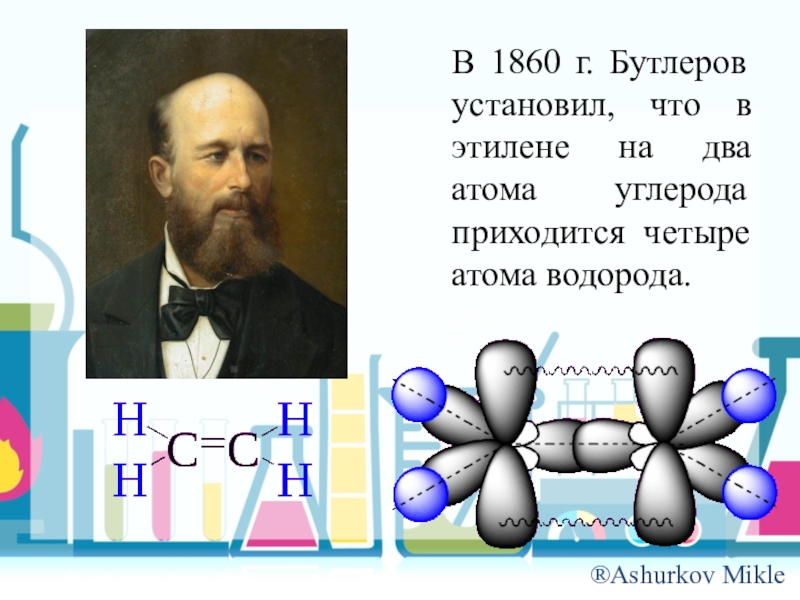
- 13. В 1860 г. Бутлеров установил, что в этилене на два атома углерода приходится четыре атома водорода.
- 14. Слайд 14
- 15. Применение этиленаВ овощехранилищах;Производство полиэтелена;Производство растворителей;Производство уксусной кислоты;Производство спиртов.
Непредельные углеводородыНепредельные или ненасыщенные углеводороды – это органические вещества состоящие только из углерода и водорода, соответствующие общей формуле CnH2n.У этих веществ двойные и тройные связи между атомами углерода, которые соединяются с максимально возможным числом атомов водорода.
Слайд 1Средняя общеобразовательная школа №2
Выполнил: учитель химии
Ашурков Михаил Федорович
Презентация
по предмету:
Химия
на тему:
«Непредельные углеводороды.
Слайд 2Непредельные углеводороды
Непредельные или ненасыщенные углеводороды – это органические вещества состоящие только
из углерода и водорода, соответствующие общей формуле CnH2n.
У этих веществ двойные и тройные связи между атомами углерода, которые соединяются с максимально возможным числом атомов водорода.
У этих веществ двойные и тройные связи между атомами углерода, которые соединяются с максимально возможным числом атомов водорода.
Слайд 4Алкены
Определение алкенов
Изомерия
Номенклатура
Получение
Химические свойства
Физические свойства
Применение
Слайд 5Определение алкенов
Алкены (олефины, этиленовые УВ) CnH2n, n>2
Алкены – это углеводороды, в
молекулах которых два атома углерода находятся в состоянии Sp2 – гибридизации и связаны друг с другом двойной связью.
Длина связи C=C в алкенах равна 0,134 нм.
Длина связи C=C в алкенах равна 0,134 нм.
Слайд 6Sp2 – гибридизации
Рис. 1. Образование sp2 – гибридных орбиталей.
Рис. 2. Модель
атома с sp2 – гибридными орбиталями.
Слайд 7Изомерия
Для алкенов возможно 4 типа изомерии:
изомерия углеродной цепи;
изомерия положения двойной связи;
цис-,
транс- изомерия;
классов соединений (циклоалканы).
классов соединений (циклоалканы).
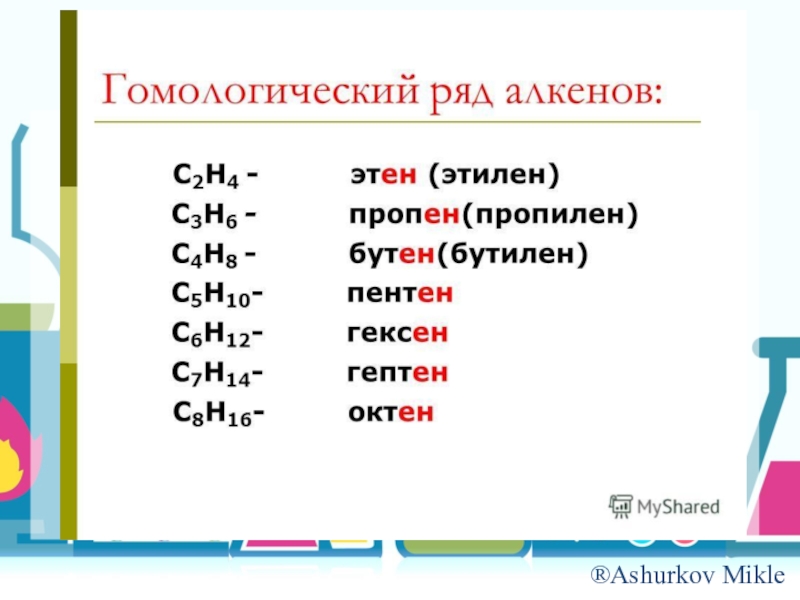
Слайд 8Номенклатура
CnH2n
-ан → -ен или –илен
В качестве главной выбирают цепь, включающую двойную
связь, даже если она не самая длинная.
Нумерация с того конца, к которому ближе двойная связь.
Положение = связи указывают в конце, номером атома углерода, после которого она находится.
В начале названия – положение боковых цепей.
Исключение: пентан – пентен или амилен
Радикалы: CH2 = CH – винил
CH2 = CH – CH2 - алил
Нумерация с того конца, к которому ближе двойная связь.
Положение = связи указывают в конце, номером атома углерода, после которого она находится.
В начале названия – положение боковых цепей.
Исключение: пентан – пентен или амилен
Радикалы: CH2 = CH – винил
CH2 = CH – CH2 - алил
Слайд 9Физические свойства
C2 – C4 – газы;
C5 – C16 – жидкости;
C >
19 – твердые;
p < 1 г/см, мало растворимые в воде;
Tкип.(цис) > Tкип.(транс)
p < 1 г/см, мало растворимые в воде;
Tкип.(цис) > Tкип.(транс)
Слайд 10Химические свойства
Активны из-за наличия непрочной π- связи;
Характерны реакции присоединения;
Гидрирования (присоединение водорода)
Галогенирование
( +HaI2)
качественная реакция
Гидрогалогенирование ( +HHaI2)
качественная реакция
Гидрогалогенирование ( +HHaI2)
пропен
пропан
пропен
1, 2 - дибромпропан
этен
хлорэтан
Слайд 11История открытия этилена
Немецкий ученый Иоганн Иохим Бехер в 1669 г. проводил
опыт: нагревал этиловый спирт с серной кислотой и получил ранее неизвестный газ, который назвали «газ Бехера»
Слайд 12История открытия этилена
В 1795 году голландский химик И. Дейман установил, что
«газ Бехера» состоит из углерода и водорода, при взаимодействии с хлором превращается в маслянистую жидкость (1,2 – дихлорэтан).
Откуда: олефины (маслородный)
Откуда: олефины (маслородный)
Слайд 13В 1860 г. Бутлеров установил, что в этилене на два атома
углерода приходится четыре атома водорода.