- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Неметаллы. Рассмотрим на примере подгруппы галогены.
Содержание
- 1. Неметаллы. Рассмотрим на примере подгруппы галогены.
- 2. Неметаллы, химические элементы, которые образуют простые тела,
- 3. Только два Неметалла — углеродТолько два Неметалла
- 4. За исключением инертных газов, имеющих весьма
- 5. В периодической системе элементовВ периодической системе
- 6. Фтор, хлор, бром и йод- элементы жизненно
- 7. В VII группе главной подгруппе находятся
- 8. Все галогены образуют простые вещества, кристаллическая решетка
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Применение гелия
- 15. Л И
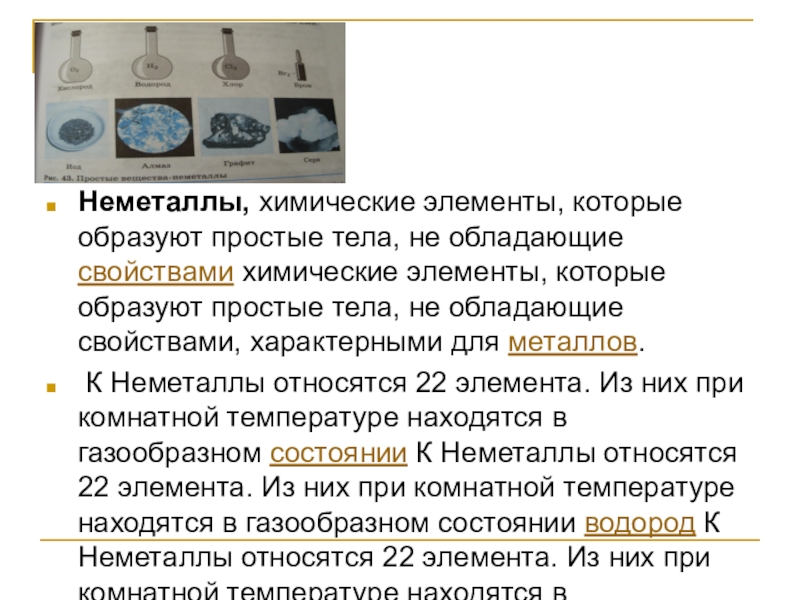
Слайд 2Неметаллы, химические элементы, которые образуют простые тела, не обладающие свойствами химические
К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний, фосфор К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний, фосфор, сера К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний, фосфор, сера, мышьяк К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний, фосфор, сера, мышьяк, селен К Неметаллы относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком — бром, в твёрдом — бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, йод, астат.
Слайд 3Только два Неметалла — углеродТолько два Неметалла — углерод и сера
В 1789 А. Л. Лавуазье В 1789 А. Л. Лавуазье включил эти Неметаллы в список простых веществ (кроме хлора, который тогда считали окисленной соляной кислотой). В 1-й половине 19 в. были получены бром, йод, селен, кремний, бор. Изолировать фтор и открыть инертные газы удалось лишь в конце 19 в. Астат получен искусственно в 1940.
Слайд 4 За исключением инертных газов, имеющих весьма устойчивую внешнюю электронную оболочку
Слайд 5 В периодической системе элементовВ периодической системе элементов Д. И. Менделеева
Наиболее электроотрицательны галогены — элементы подгруппы VIIa; их электроотрицательность убывает от фтора до астата.
С кислородомС кислородом Неметаллы образуют кислотные окислы, дающие кислоты при соединении с водой; сила их убывает от подгруппы VIIa до IVa.
Простейшие соединения Неметаллы с водородом при комнатной температуре газообразны; водные растворы водородных соединений Неметаллы подгруппы VIla — сильные кислоты.
Соединения Неметаллы друг с другом, например фторид хлора CIF, хлорид йода ICl, дисульфид углерода (сероуглерод) CS2, характеризуются ковалентной связью.
В соединениях типичных Неметаллы с металлами связь по преимуществу ионная, например, в хлориде калия KCl, окиси магния MgO, трибромиде алюминия AlBr3.
Слайд 6Фтор, хлор, бром и йод- элементы жизненно необходимые для организма человека:
Слайд 7 В VII группе главной подгруппе находятся самые сильные неметаллы, галогены
Слайд 8Все галогены образуют простые вещества, кристаллическая решетка у которых молекулярная, образованная
Фтор – светло-зеленый газ, имеет резкий раздражающий запах, ядовитый, температура плавления – 219,6 º С, температура кипения – 188,1ºС.
Хлор – зеленовато-желтый газ, имеет резкий удушливый запах, ядовитый, температура плавления – 101 ºС, температура кипения – 34,1 ºС. Бром– летучая красно-бурая жидкость, имеет резкий зловонный запах, температура плавления – 7,3 ºС, температура кипения - 59,2 ºС.
Йод – черно-фиолетовые кристаллы, имеет резкий зловонный запах, имеет блеск, температура плавления 13,6 ºС, температура кипения 185,5 ºС. Астат - черно- синие кристаллы, имеет блеск, температура плавления 227 ºС, температура кипения 317 ºС.
В химических реакциях галогены будут принимать один недостающий электрон, при этом они будут являться окислителями и проявлять неметаллические свойства. Галогены вступают в реакции с восстановителями: с металлами и водородом. Г + 1е = Г¯, а также все, кроме фтора, окисляются кислородом, являясь восстановителями, фтор – самый сильный окислитель, восстановителем не является. Галогены образуют летучие водородные соединения, которые при растворение в воде образуют кислоты.(H2 + Г → НГ) HF - фтороводородная , плавиковая кислота. HCl – хлороводородная , соляная кислота. HBr – бромоводородная кислота.
Слайд 9
Фтор - ядовитый газ, широко применён человеком, но неядовитые соединения (фториды) добавляют в зубную пасту и воду. Биологическое значение фтора огромно. Он участвует в построении зубной эмали и костей, предотвращает заболевания зубов, кариес. Он необходимый элемент в процессах обмена веществ в железах, мышцах и нервных клетках. Фтор используют в промышленности и электротехнике. Его соединения с углеродом используются для получения соединений фтороуглеводов, которые используются для получения тефлоновых покрытий кухонной посуды и лыж.
Слайд 10
Хлор – один из главных элементов, без которого не могут существовать живые организмы. Содержится во многих продуктах потребления, это – его основная форма поступления в организм, он стимулирует обмен веществ, входит в состав плазмы крови, определяет рост волос, придает бодрость и силу, без ионов хлора, практически прекращается процесс переваривания пищи.
В промышленности он применяется для отбеливания льна, бумаги и тканей, а также в органическом синтезе пластмасс, каучуков, красителей и растворителей, как дезинфицирующее средство. Он продукт химической промышленности, на его основе производят хлороводородную кислоту, поливинилхлоридный пластик.
Хлорид натрия – поваренная соль является основным компонентом питания, гипохлорид натрия входит в состав побелки для стен и используется для отбеливания бумажной массы. Хлор природе встречается только в виде соединений: хлорид натрия, сильвинит и другие. В лабораторных условиях его получают из соляной кислоты с помощью сильных окислителей: оксида марганца и перманганата калия.
Слайд 11 Б
Бром регулирует процессы возбуждения и торможения центральной нервной системы, поэтому его используют для лечения нервных заболеваний. Бром используют в медицине для получения раствора бромида натрия. Бромид серебра используют в производстве фотографической пленки.
Слайд 12 Й
Йод – это элемент, без которого не может жить человек, недостаток йода приводит к снижению выработки гормонов щитовидной железы и заболеванию эндемическим зобом. Под регулированием гормона щитовидной железы находятся мускульное возбуждение, биение сердца, пищеварение, работа мозга и температура человека.
Йод широко используется в медицине, в изготовлении фотографической пленки, служит компонентом некоторых красителей. Йод содержится в некоторых пищевых морепродуктах, его получают из иодида натрия
Слайд 13
Астат- радиоактивен. Количество астата в земной коре незначительно, он случайно появляется в виде изотопов во время проведения некоторых экспериментов. Его свойства недостаточно изучены.
Слайд 15 Л И Т Е Р А
Н.В. Коровин, Г.Н. Масленников, Э.И. Мингулина и Э.Л. Филиппов – «курс общей химии».
«Краткая химическая энциклопедия».(издательство «Советская энциклопедия», 2001г.)
Н.А. Глинка – «Общая химия»(издательство «Химия», 2007г.)