- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему На урок химии, 9 класс: Атомная кристаллическая решетка. Углерод
Содержание
- 1. На урок химии, 9 класс: Атомная кристаллическая решетка. Углерод
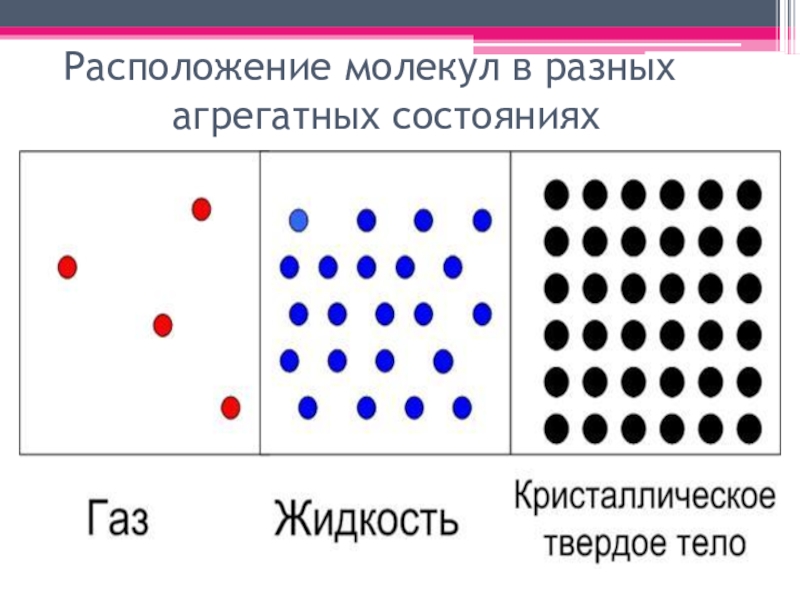
- 2. Расположение молекул в разных агрегатных состояниях
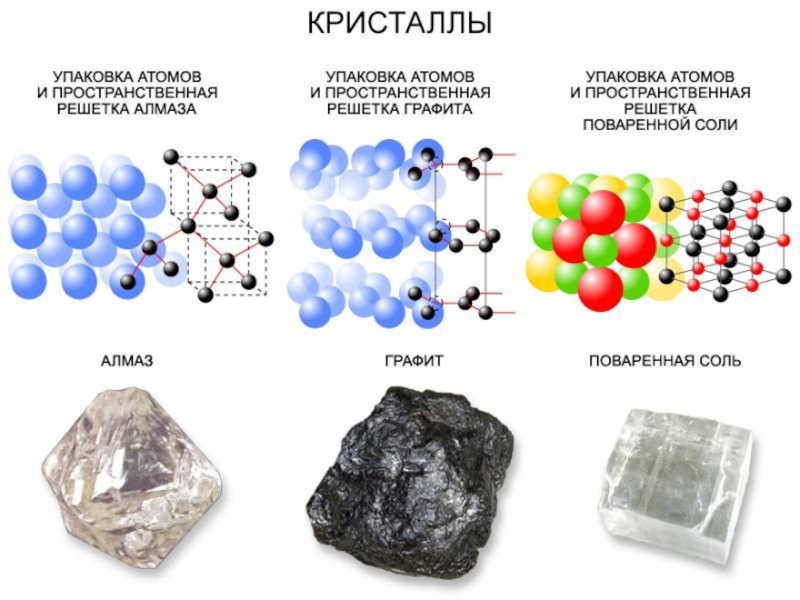
- 3. В атомных кристаллах атомы связаны ковалентной неполярной
- 4. Слайд 4
- 5. Алмаз.
- 6. ОпределениеАлмаз – чрезвычайно устойчивая форма углерода, и
- 7. БриллиантыИз алмазов особой огранкой, специально выявляющей его
- 8. определениеГрафит – черное, пачкающее бумагу и руки
- 9. Графит и алмаз – это различные кристаллические
- 10. В общем случае способность простого вещества существовать
Расположение молекул в разных агрегатных состояниях
Слайд 3В атомных кристаллах атомы связаны ковалентной неполярной связью. Характерным примером таких
веществ является алмаз, в кристаллической решетке которого все наиближайшие межъядерные расстояния и все углы между четырьмя связями атома углерода равны. Тетраэдрический угол между этими связями свидетельствует об sp3-гибридном состоянии валентных электронных орбиталей атома углерода.
Модель кристаллической решетки алмаза показана на рис.
Слайд 6Определение
Алмаз – чрезвычайно устойчивая форма углерода, и не известно ни одного
случая самопроизвольного перехода при обычных условиях алмаза в графит. Мы говорим о кинетической устойчивости алмаза, т. к. термодинамически более устойчивой формой углерода является графит. При нагревании алмаза без доступа воздуха выше температуры 1200 °С начинается его переход в графит.
Слайд 7Бриллианты
Из алмазов особой огранкой, специально выявляющей его блеск, изготовляют бриллианты, сверкающие
всеми цветами радуги в отраженном свете. Бриллианты – очень дорогие драгоценные камни (масса бриллианта измеряется в каратах, 1 карат = 0,2 г). Алмаз не проводит электрический ток.
Слайд 8определение
Графит – черное, пачкающее бумагу и руки вещество, проводящее электрический ток.
Кристаллическая структура графита совсем не похожа на структуру алмаза. Атомы углерода в графите расположены плоскими сетками, причем углы между связями равны 120°. Это позволяет предположить, что валентные электронные орбитали атома углерода находятся в sp2-гибридном состоянии и каждый атом связан с тремя другими атомами Интересно заметить, что связи С–С в графите более прочные, чем связи в алмазе.
Слайд 9
Графит и алмаз – это различные кристаллические формы, построенные из одинаковых
атомов. Явление изменения кристаллической структуры одного и того же вещества при изменении внешних условий называется полиморфизмом, а сами эти вещества с различной кристаллической структурой называются полиморфными модификациями. Алмаз и графит – полиморфные модификации углерода. Полиморфизм относится только к кристаллическим веществам.
Слайд 10
В общем случае способность простого вещества существовать в различных формах называется
аллотропией. Графит и алмаз можно назвать аллотропными модификациями углерода и одновременно его полиморфными модификациями.
Газообразные кислород О2 и озон О3 – это аллотропные модификации кислорода, но не полиморфные.
http://him.1september.ru/2003/21/4.htm
http://him.1september.ru/2003/21/4.htm