- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Мультимедийная разработка урока по дисциплине Химия. Алкины
Содержание
- 1. Мультимедийная разработка урока по дисциплине Химия. Алкины
- 2. СодержаниеЦель и задачи занятияСодержание занятия МПС, ВПСОборудование,
- 3. Цель занятия: показать методику проведения комбинированного занятия
- 4. Методическая цель: связь теоретического обучения с практическим обучением.
- 5. Оборудование, учебно-наглядные пособия:Компьютер;Устройство отображение (телевизор)Основной метод: частично-поисковыйТип занятия: изучение нового материалаРаздаточный материал: научно-популярная литература
- 6. 1. Ход занятия1. Организационный момент.(Цель этапа: быстрое
- 7. 2. Фронтальный опрос2.1. Какие вещества называют углеводородами?2.2.
- 8. 2. Фронтальный опрос2.5. Какой тип гибридизации характерен
- 9. 3. Начальная мотивацияСегодня на занятии мы познакомимся
- 10. Слайд 10
- 11. 4. Изучение нового материалаПреподаватель показывает два слайда.
- 12. Строение непредельных углеводородов ряда этилена. Строение алкенов.δ
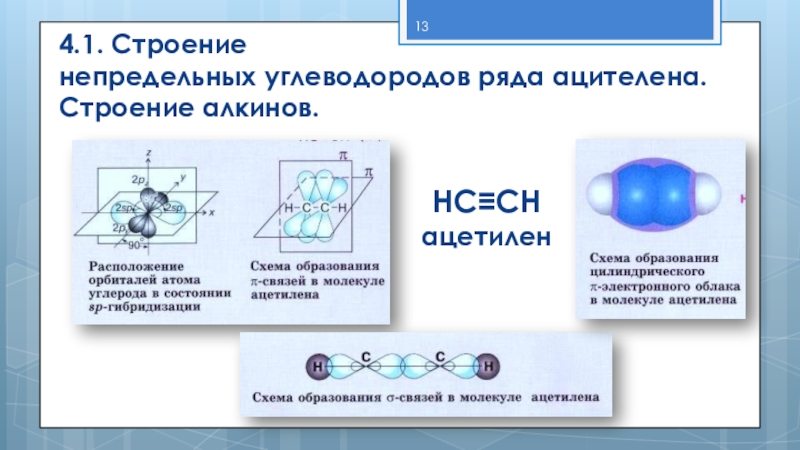
- 13. 4.1. Строение непредельных углеводородов ряда ацителена. Строение алкинов.HC≡CHацетилен
- 14. Вид гибридизации –
- 15. На основании различия строений, преподаватель просит учащихся
- 16. Общая формула алкиновСnH2n-2
- 17. Гомологический ряд алкеновC2H2 этинC3H4 пропинC4H6
- 18. Слайд 18
- 19. Слайд 19
- 20. С4.2. Номенклатура1. Выбор главной цепи.НН3ССССССН3Н32. Нумерация атомов главной цепи.НН3ССССССН3Н3123453. Формирование названия.НН3СССССН3Н34 - метилпентин- 2
- 21. СНСНСН3Изомерия1. Структурная изомерия.СН3ССНСН3СH CСНбутин - 12. Изомерия положения двойной связи.СН3СН2ССН3ССН3бутин - 1бутин - 2СН33-метилбутин 1
- 22. 3. Межклассовая изомерия с алкадиенами и циклоалкенами,
- 23. Способы получения:1. Термический крекинг метана:4.3 Получение
- 24. 3. Дегидрогалогенирование дигалогеналкилов2. Гидролиз карбида кальция:CaC2 + 2H2O C2H2 + Ca(OH)2Получение
- 25. BrПолучение4. Дегидрогалогенирование (отщепление галогеноводорода): СН3СНСН3+ 2NaОНспирт, t
- 26. Слайд 26
- 27. 4.4. ФизическиесвойстваАгрегатное состояние:С2Н2 – С3Н4газообразные вещества;С4Н6 –
- 28. 4.5. Химические свойства ацетилена и его гомологовВ
- 29. Слайд 29
- 30. Слайд 30
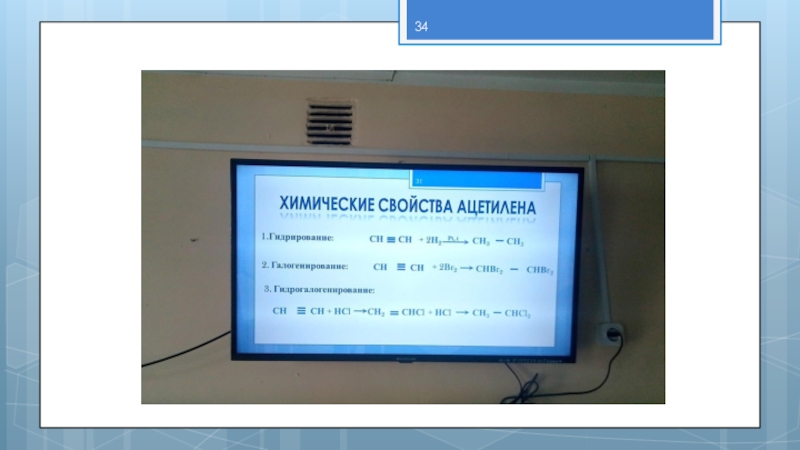
- 31. Pt, tХимические свойства ацетилена1.Гидрирование:
- 32. 4. Гидратация:СН СН + Н2Оt, HgSO4CНСНОНН]]СН3 C
- 33. Окисление7. Горение ( t = 2500ºC)2СН СН
- 34. Слайд 34
- 35. 4.6. Применение алкиновПреподаватель раздает научно-популярную литературу и
- 36. Слайд 36
- 37. Слайд 37
- 38. Сварка металлов;Синтез уксусной кислоты, тетрахлорэтана и т.д.;Производство синтетического каучука;Производство поливинилхлоридов и других полимеровПрименение
- 39. 5. Закрепление полученных знаний:Решение тестового задания. Взаимопроверка.
- 40. Слайд 40
- 41. 5.1. Тестовое задание1. Общая формула алкиновCnH2n-2CnH2n+2CnH2n2. Тип гибридизации атомов в пропинеsp, sp3,sp2sp2,sp2,spsp,sp,sp3
- 42. 3. Какой вид гибридизации отсутствуету алкинов:Углеводородного скелетаПоложение тройной связиПоложение функциональной группы4. Алкинам не характерны реакции:ЗамещениеОкислениеПрисоединение
- 43. 6. Конечная мотивацияСегодня, мы познакомились с
- 44. 7. Подведение итоговПреподаватель подводит итоги работы на
- 45. Слайд 45
- 46. 8. Используемая литература1. Габриелян О. С. ,
Слайд 1ГАУ КО «Колледж предпринимательства»
Алкины
Выполнила:
Прокофьева Галина Алексеевна,
преподаватель химии
г. Калининград, 2018
Мультимедийная
по дисциплине «Химия»
в группе обучающихся 1 курса, специальность 09.02.07
«Информационные системы и программирование»
Слайд 2Содержание
Цель и задачи занятия
Содержание занятия МПС, ВПС
Оборудование, метод, тип, материалы занятия
1.
2. Фронтальный опрос
3. Начальная мотивация
4. Изучение нового материала
4.1. Строение
4.2. Номенклатура
4.3. Изомерия
4.4. Физические свойства
4.5. Химические свойства
4.5. Применение алкинов
5. Закрепление полученных знаний:
5.1. Тестовое задание
6. Конечная мотивация
7. Подведение итогов
8. Используемая литература
Слайд 3Цель занятия: показать методику проведения комбинированного занятия с использование компьютерной презентации.
Задачи
- Познавательные – ознакомить учащихся с гомологическим рядом, особенностями строения, изомерией и номенклатурой алкинов.
- Развивающие – развивать полученные ранее первоначальные представления об изомерии и умения давать названия соединениям по номенклатуре ИЮПАК. Развивать логическое мышление, умения сравнивать, сопоставлять, делать выводы, устанавливать причинно - следственные связи. Развивать умения по работе с текстом, с таблицами, по работе в группах. - Воспитательные – воспитывать желание учиться активно, с интересом, прививать сознательную дисциплинированность, чёткость и организованность в работе.
Слайд 4Методическая цель: связь теоретического обучения с практическим обучением.
Содержание занятия:
повторить пройденный материал;
изложить
закрепить полученные знания;
проконтролировать качество усвоения нового материала и оценить знания учащихся.
МПС: Биология, физика(электричество).
ВПС: Алкены, высокомолекулярные соединения
Слайд 5Оборудование, учебно-наглядные пособия:
Компьютер;
Устройство отображение (телевизор)
Основной метод: частично-поисковый
Тип занятия: изучение нового материала
Раздаточный материал:
Слайд 61. Ход занятия
1. Организационный момент.
(Цель этапа: быстрое включение учащихся в рабочий
Взаимное приветствие преподавателя и учащихся.
Принятие рапорта у дежурного о посещаемости, проверка готовности учащихся к занятию.
2. Повторение пройденного материала.
(Цель этапа: актуализация опорных знаний, умений и мотивационных состояний.)
1. Фронтальный опрос
2. Обобщение ответов учащихся и переход к восприятию нового материала.
Слайд 72. Фронтальный опрос
2.1. Какие вещества называют углеводородами?
2.2. Какие классы органических веществ
2.3. Почему непредельные углеводороды так названы?
2.4. Каковы особенности строения непредельных углеводородов ряда этилена?
Слайд 82. Фронтальный опрос
2.5. Какой тип гибридизации характерен для непредельных углеводородов ряда
2.6. Назовите валентный угол и длину связи С – С в молекулах алкенов.
2.7. Что такое изомерия? Какие виды изомерии вам известны?
2.8. Какой вид изомерии характерен для алкенов?
2.9. Какие вещества называют гомологами?
Слайд 93. Начальная мотивация
Сегодня на занятии мы познакомимся с одним из классов
Слайд 114. Изучение нового материала
Преподаватель показывает два слайда. Строение непредельных углеводородов ряда
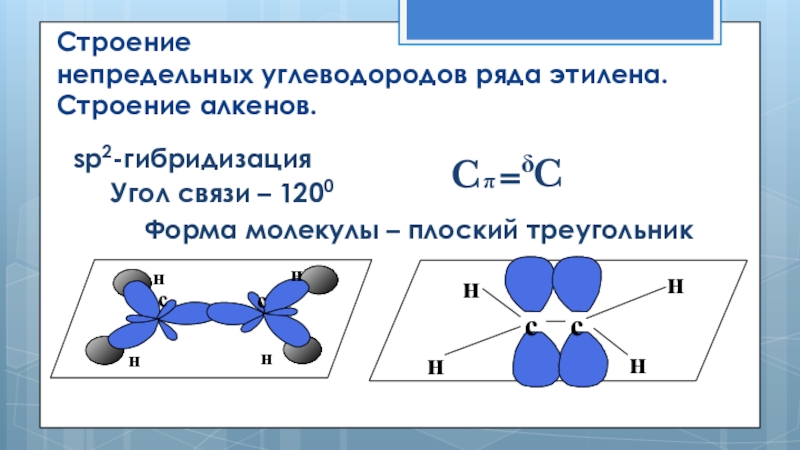
Слайд 12Строение
непредельных углеводородов ряда этилена. Строение алкенов.
δ
sp2-гибридизация
Угол связи – 1200
Форма
C
π
C
Слайд 14Вид гибридизации – sp
Валентный угол –
Длина связи С ≡ С – 0,12 нм
Строение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π
Характеристика тройной связи
Строение
Слайд 15На основании различия строений, преподаватель просит учащихся вывести общую формулу алкинов,
Строение
Слайд 17Гомологический ряд алкенов
C2H2 этин
C3H4 пропин
C4H6 бутин
C5H8 пентин
C6H10
C7H12 гептин
C8H14 октин
C9H16 нонеин
C10H18 декин
Слайд 20С
4.2. Номенклатура
1. Выбор главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н3
2. Нумерация атомов главной цепи.
Н
Н3
С
С
С
С
С
СН3
Н3
1
2
3
4
5
3. Формирование названия.
Н
Н3
С
С
С
С
СН3
Н3
4
пентин
- 2
Слайд 21СН
СН
СН3
Изомерия
1. Структурная изомерия.
СН3
С
СН
СН3
СH C
СН
бутин - 1
2. Изомерия положения двойной связи.
СН3
СН2
С
СН3
С
СН3
бутин
бутин - 2
СН3
3-метилбутин 1
Слайд 223. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН =
СН С–СН2–СН3 СН2=СН–СН=СН2
СН2 –СН2
бутин-1 бутадиен-1,3 циклобутен
Изомерия
Слайд 243. Дегидрогалогенирование дигалогеналкилов
2. Гидролиз карбида кальция:
CaC2 + 2H2O C2H2 +
Получение
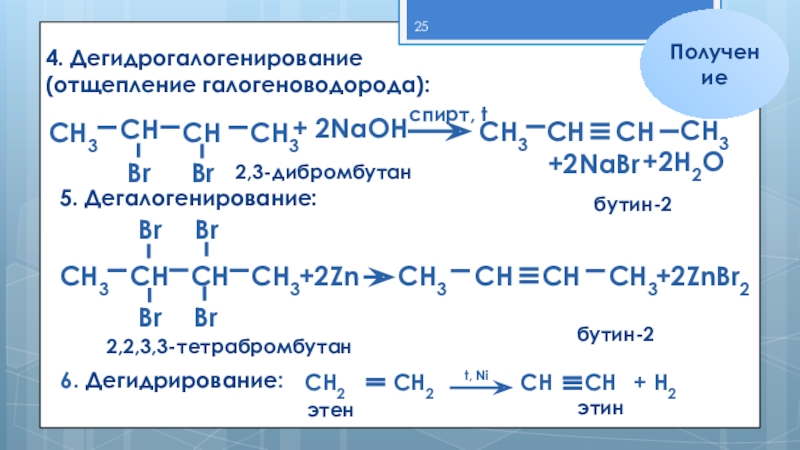
Слайд 25Br
Получение
4. Дегидрогалогенирование
(отщепление галогеноводорода):
СН3
СН
СН3
+ 2NaОН
спирт, t
СН
СН3
СН
СН
СН3
+2NaBr
+2Н2О
5. Дегалогенирование:
СН3
СН
СН3
СН
+2Zn
Br
Br
СН3
СН
СН
СН3
+2ZnBr2
Br
Br
Br
2,3-дибромбутан
бутин-2
2,2,3,3-тетрабромбутан
бутин-2
СН
6. Дегидрирование:
СН2
СН2
t, Ni
СН
+ Н2
этен
этин
Слайд 274.4. Физические
свойства
Агрегатное состояние:
С2Н2 – С3Н4
газообразные вещества;
С4Н6 – С16Н30
жидкости;
с С17Н32
твердые вещества
С увеличением
Слайд 284.5. Химические свойства ацетилена и его гомологов
В основном определяются наличием в
Слайд 31Pt, t
Химические свойства ацетилена
1.Гидрирование:
СН
СН
+ 2Н2
СН3
СН3
2. Галогенирование:
СН
СН
+ 2Br2
СНВr2
СНВr2
3. Гидрогалогенирование:
СН
СН
+ НСl
CН2
СНСl
+ НСl
СН3
СНCl2
Слайд 324. Гидратация:
СН
СН
+ Н2О
t, HgSO4
CН
СН
ОН
Н
]
]
СН3
C H
О
5. Полимеризация. Алкины ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
kat
HC≡CH + HC≡CH →CH2=CH–C≡CH винилацетилен
kat
CH2=CH–C≡CH + HC≡CH →CH2=CH–C≡C–CH=CH2
б) Тримеризация для ацетилена
Cакт.,t
3СH≡CH → С6Н6 бензол
Слайд 33Окисление
7. Горение ( t = 2500ºC)
2СН СН + 4O2 →CO2 +
2C2H2 + 5O2 → 4CO2 + 2H2O +Q
8. В присутствии перманганата калия ацетилен легко окисляется в до щавелевой кислоты (обесцвечивание раствора KMnO4 является качественной реакцией на наличие тройной связи).
3C2H2 + 8KMnO4 + 4H2O → 3HOOC-COOH + +8MnO2 + +8KOH
Химические
свойства
Слайд 354.6. Применение алкинов
Преподаватель раздает научно-популярную литературу и просит учащихся выбрать области
Слайд 38
Сварка металлов;
Синтез уксусной кислоты, тетрахлорэтана и т.д.;
Производство синтетического каучука;
Производство поливинилхлоридов и
Применение
Слайд 395. Закрепление полученных знаний:
Решение тестового задания. Взаимопроверка. Студенты меняются тетрадями и
Слайд 415.1. Тестовое задание
1. Общая формула алкинов
CnH2n-2
CnH2n+2
CnH2n
2. Тип гибридизации атомов в пропине
sp,
sp2,sp2,sp
sp,sp,sp3
Слайд 423. Какой вид гибридизации отсутствует
у алкинов:
Углеводородного скелета
Положение тройной связи
Положение функциональной группы
4.
Замещение
Окисление
Присоединение




























![Мультимедийная разработка урока по дисциплине Химия. Алкины 4. Гидратация:СН СН + Н2Оt, HgSO4CНСНОНН]]СН3 C H этаналь 4. Гидратация:СН СН + Н2Оt, HgSO4CНСНОНН]]СН3 C H этаналь О5. Полимеризация. Алкины](/img/thumbs/3f23da3e36d04ba5a0ee9506c091b4e2-800x.jpg)