- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Методическая разработка урока Форсфор и его соединения
Содержание
- 1. Методическая разработка урока Форсфор и его соединения
- 2. Не нужен университет, Ни Кембридж, и ни Оксфорд, Чтобы узнать: латинской «Р» Обозначают …
- 3. План урокаПаспортные данные фосфораСтанция историческаяСтанция «Аллотропные модификации»Станция геологическаяСтанция химическаяСтанция здоровьяСтанция прикладнаяСтанция поэтическаяСтанция контрольная
- 4. Паспортные данныефосфора
- 5. Перечислите элементы V группы.
- 6. Охарактеризуйте фосфор по положению в периодической системе химических элементов Д.И. Менделеева.
- 7. Опишите электронное строение атома фосфора.
- 8. В чем сходство и различие в строении атомов азота и фосфора?
- 9. Напишите формулу его высшего оксида, укажите его характер.
- 10. Напишите формулу летучего водородного соединения фосфора.
- 11. У какого элемента сильнее выражены неметаллические свойства: а) азот, фосфор, мышьяк; б) кремний, фосфор, сера?
- 12. Станция историческая
- 13. К.В. Шееле (1742–1786) Вскоре Ю.
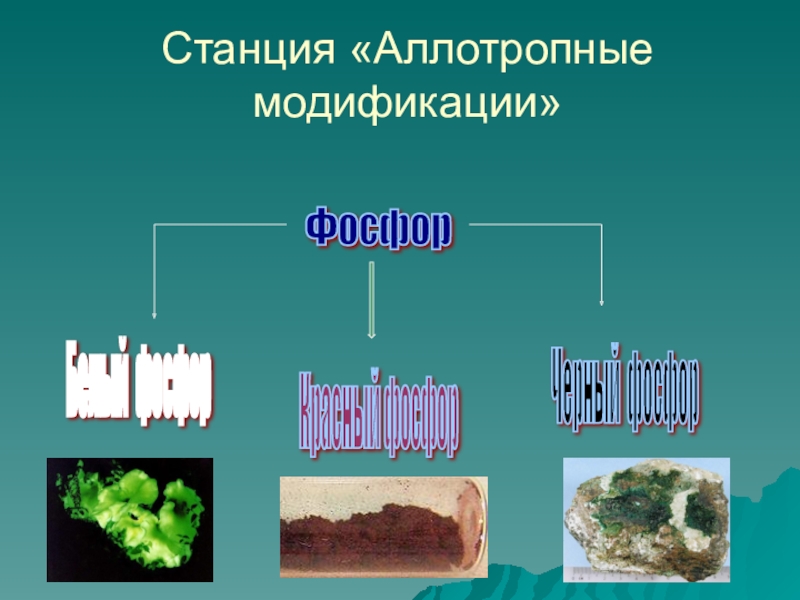
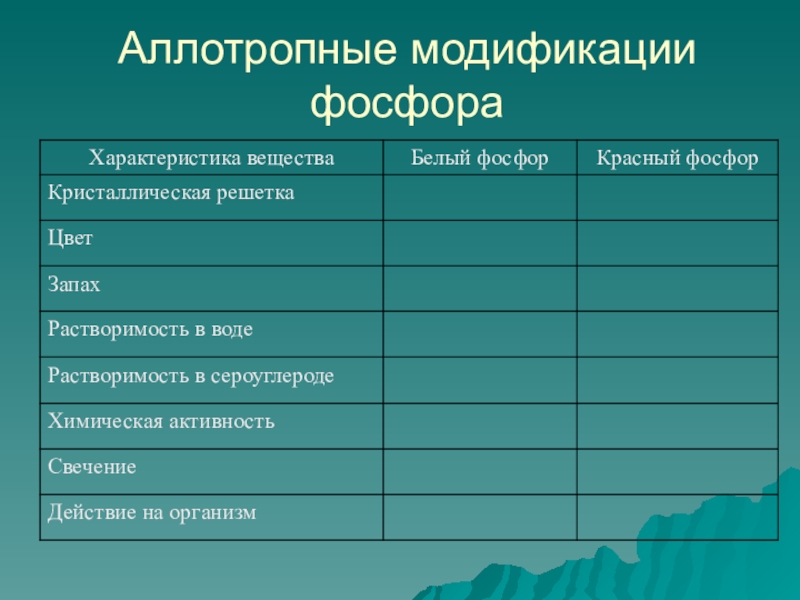
- 14. Станция «Аллотропные модификации»Фосфор Белый фосфор Красный фосфор Черный фосфор
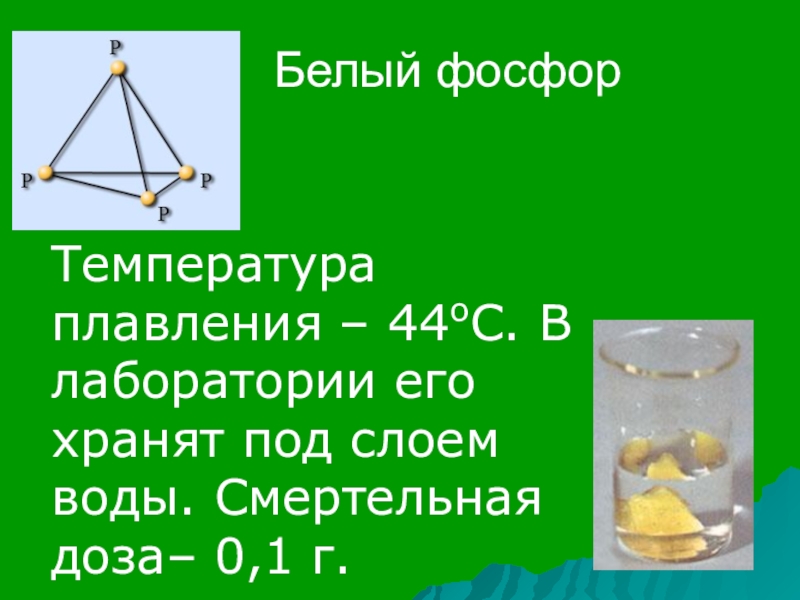
- 15. Белый фосфорТемпература плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.
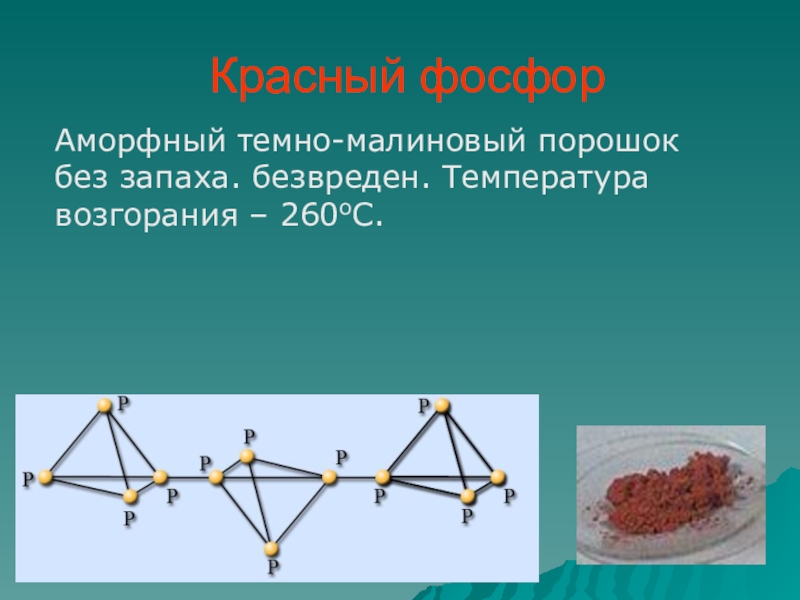
- 16. Красный фосфорАморфный темно-малиновый порошок без запаха. безвреден. Температура возгорания – 260оС.
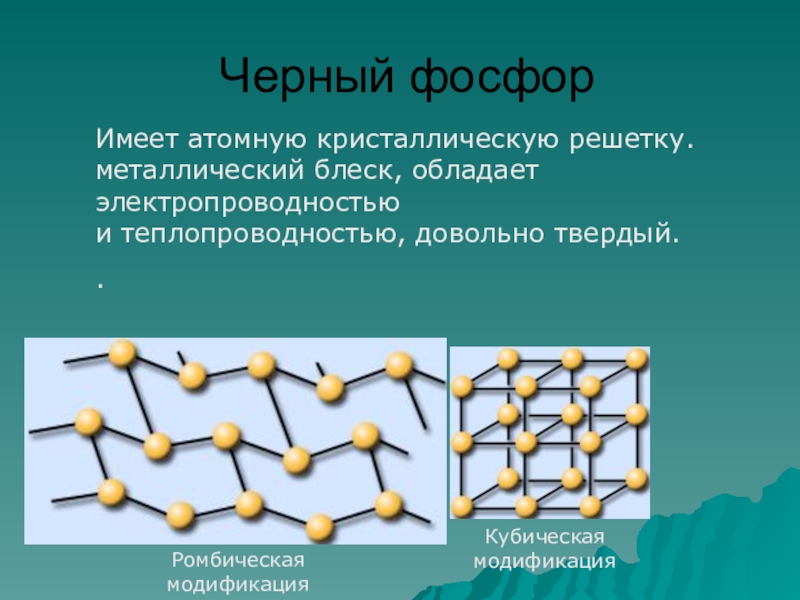
- 17. Черный фосфорРомбическая модификацияКубическая модификацияИмеет атомную кристаллическую решетку.
- 18. Аллотропные модификации фосфора
- 19. Изучите аллотропные модификации фосфора и найдите ошибку в тексте.
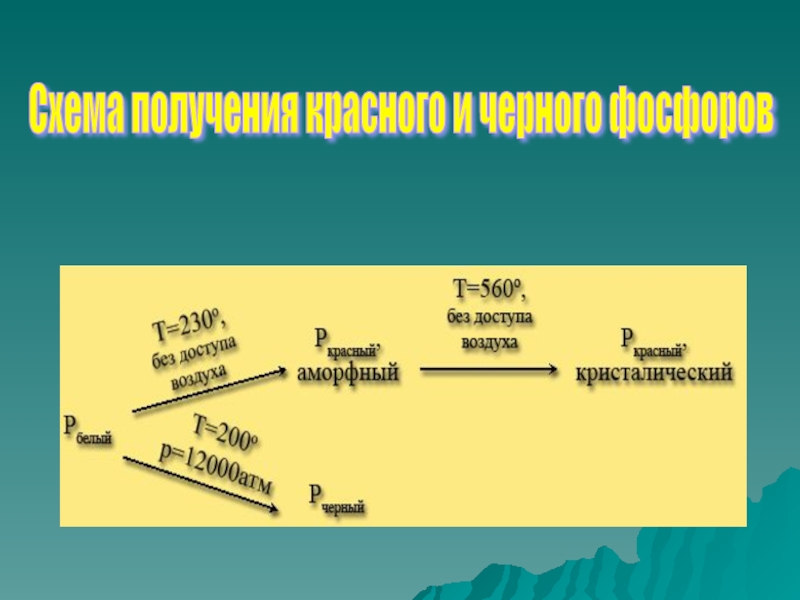
- 20. Схема получения красного и черного фосфоров
- 21. Станция геологическаяФосфор встречается в природе только в
- 22. Станция химическаяВзаимодействие с активными металлами: Mg + P
- 23. Станция здоровьяПо содержанию в организме человека фосфор
- 24. Станция прикладнаяБолее половины объема мирового производства фосфора
- 25. Станция поэтическая Я светоносный элемент. Я спичку вам зажгу
- 26. Знаете ли вы, что…пшеница при среднем урожае
- 27. Станция контрольная1. Сколько электронов в атоме фосфора
- 28. 9. Какое из аллотропных видоизменений фосфора ядовито:белый;
- 29. Ответы:1) 32) 33) 24) 15) 16) 27)
- 30. Домашнее задание п. 21 стр.70 №2,4,5
Слайд 3План урока
Паспортные данные фосфора
Станция историческая
Станция «Аллотропные модификации»
Станция геологическая
Станция химическая
Станция здоровья
Станция прикладная
Станция
Станция контрольная
Слайд 6Охарактеризуйте фосфор по положению
в периодической системе химических элементов
Д.И. Менделеева.
Слайд 11У какого элемента сильнее выражены неметаллические свойства: а) азот, фосфор, мышьяк;
Слайд 13 К.В. Шееле
(1742–1786)
Вскоре Ю. Ган и К Шееле доказали,
Немного позже Ж. Пруст и М. Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция.
Антуан Лоран
Лавуазье
В начале 70-х гг. XVIII в. великий французский ученый А. Лавуазье, сжигая фосфор в замкнутом объеме воздуха, доказал, что фосфор – самостоятельный химический элемент.
В 1799 г. было доказано, что соединения фосфора необходимы для нормального развития растений.
Бриджмен
В 1847 г. немецкий химик Шретер получил красный фосфор. В 1934 г. американский ученый Бриджмен выделил черный фосфор. Впоследствии были выделены фиолетовый и коричневый фосфор.
Слайд 15Белый фосфор
Температура плавления – 44оС. В лаборатории его хранят под слоем
Слайд 16Красный фосфор
Аморфный темно-малиновый порошок без запаха. безвреден. Температура возгорания – 260оС.
Слайд 17Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную кристаллическую решетку.
металлический блеск, обладает электропроводностью
.
Слайд 21Станция геологическая
Фосфор встречается в природе только в связанном состоянии. Массовая доля
Важнейшие минералы:
Сa3(PO4)2 – фосфорит;
3Сa3(PO4)2∙Ca(OH)2 – гидроксиапатит;
3Сa3(PO4)2∙CaF2 – фторапатит.
В 1806 г. Ф. Велер предложил получение фосфора
из фосфата кальция, песка и угля. Расставьте коэффициенты в уравнении реакции с электронным балансом:
Слайд 22Станция химическая
Взаимодействие с активными металлами:
Mg + P →
Взаимодействие с кислородом:
Р +
P+S →
Допишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.
Слайд 23Станция здоровья
По содержанию в организме человека фосфор относится к макроэлементам (w(Р)
Фосфор входит в состав костной, нервной и мозговой тканей, крови, молока.
Фосфором богаты яйца, мясо, молоко, хлеб.
Почти все важнейшие физиологические процессы, происходящие в организме человека, связаны с превращениями соединений фосфора.
Следите за своим здоровьем!
Слайд 24Станция прикладная
Более половины объема мирового производства фосфора перерабатывается
в соединения, используемые
Соединения фосфора используют для получения антикоррозионных добавок к маслам и горючему для автомобилей.
Сульфиды фосфора стали необходимы в сражении с ржавчиной в металлургии.
Фосфор используется при производстве спичек.
Фосфор нужен для получения фосфористой бронзы.
Слайд 25Станция поэтическая
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня –
Я сразу стану кислотой.
Запишите уравнения реакций, о ко-
торых идет речь в этом стихотворе-
нии.
Слайд 26Знаете ли вы, что…
пшеница при среднем урожае из почвы берет в
исследования Луны показали присут-ствие там фосфора (w(Р) = 0,08%)?
каждый из нас носит в себе 4,5 кг фосфора в виде химических соединений?
свыше 85% содержащегося в организме фосфора приходится на долю костной ткани?
в Амстердаме в 1730 г. 31 г фосфора стоил около 80 золотых рублей?
Слайд 27Станция контрольная
1. Сколько электронов в атоме фосфора находится на внешнем энергетическом
1) 2 ; 2) 3; 3) 5; 4) 15.
2. Число нейтронов в ядре атома 31Р:
1) 5; 2) 15; 3) 16; 4) 31.
3. Максимальная степень окисления фосфора в соединениях равна:
1) +6; 2) +5; 3) +3; 4) +4.
4. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна:
1) -3; 2) 0; 3) +3; 4) +5.
5. Среди перечисленных элементов V группы типичным неметаллом является:
1) фосфор; 2) мышьяк; 3) сурьма; 4) висмут.
6. В соединениях РН3, Р205, Н3Р03 фосфор имеет степени окисления, соответственно равные:
1)+3; +5; -3; 2) -3; +5; +3; 3) -3; +3; +5; 4) +3; -5; -3.
7. Как называется соединения фосфора с металлами?
1)Фосфиты; 2) фосфаты;3) фосфиды; 4) ортофосфаты.
8. Какой фосфор обладает металлическими свойствами?
1) Белый; 2) красный; 3) черный; 4) фиолетовый
Слайд 289. Какое из аллотропных видоизменений фосфора ядовито:
белый; 2) красный; 3) черный;
10. Какую кристаллическую решетку имеет белый фосфор:
1) атомную; 2)молекулярную; 3)металлическую; 4)ромбическую
Слайд 29Ответы:
1) 3
2) 3
3) 2
4) 1
5) 1
6) 2
7) 3
8) 3
9) 1
10) 2
Проверь
Оценивание:
9-10 правильных : «5»
8-7 правильных : «4»
5-6 правильных : «3»
Менее 5 : «2»