Селютина Виктория.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Металлы второй группы главной подгруппы
Содержание
- 1. Металлы второй группы главной подгруппы
- 2. Проектно-Исследова-тельская работа. План.Положение химических элементов.Открытие химических элементов.Физические свойства.Химические свойстваПрактическое значение.
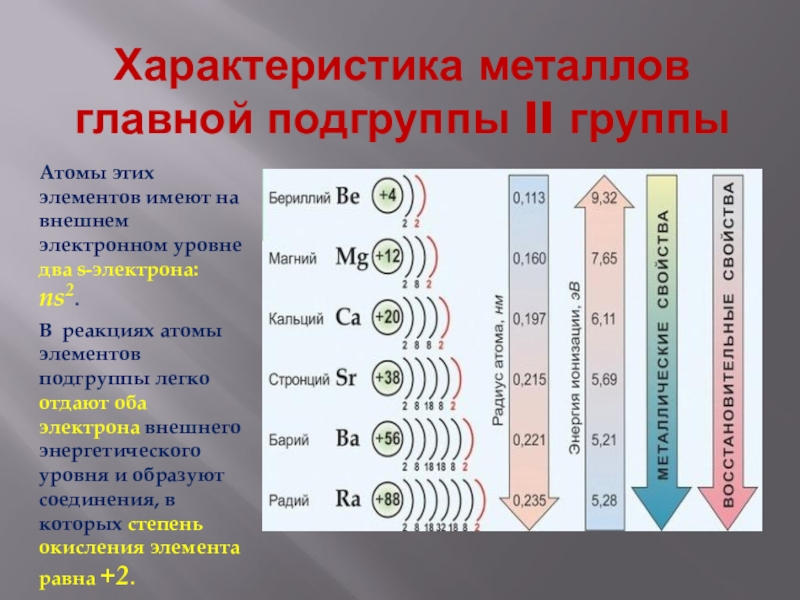
- 3. Характеристика металлов главной подгруппы II группыАтомы этих
- 4. Строение атомаЭто s-элементы. В виде простых веществ
- 5. Щелочноземельные металлыВ главную подгруппу II группы входят
- 6. Физические свойстваБериллий, магний, кальций, барий и
- 7. Слайд 7
- 8. Получение щелочноземельных металловЭлектролизом расплавов их хлоридов или
- 9. Химические свойстваЩелочноземельные элементы - химически активные металлы.
- 10. Взаимодействие с простыми веществами Все
- 11. Взаимодействие с кислотами Все взаимодействуют
- 12. Взаимодействие со щелочами Бериллий взаимодействует с
- 13. Жесткость водыЖёсткость воды - свойство воды (не
- 14. Состав морской воды
- 15. Жесткость воды Существует два
- 16. Методы устранения жесткостиДля устранения карбонатной жёсткости воду
- 17. Кальций и его практическое значение.Большая часть кальция
- 18. Радий в природеРадий довольно редок. За прошедшее
- 19. Практическое значениеВ начале века, после своего открытия,
- 20. Нахождение в природеВсе щёлочноземельные металлы имеются (в
Проектно-Исследова-тельская работа. План.Положение химических элементов.Открытие химических элементов.Физические свойства.Химические свойстваПрактическое значение.
Слайд 2Проектно-Исследова-тельская работа.
План.
Положение химических элементов.
Открытие химических элементов.
Физические свойства.
Химические свойства
Практическое значение.
Слайд 3Характеристика металлов главной подгруппы II группы
Атомы этих элементов имеют на внешнем
электронном уровне два s-электрона: ns2.
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
Слайд 4Строение атома
Это s-элементы. В виде простых веществ типичные металлы. На внешнем
уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2. В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее.
Слайд 5Щелочноземельные металлы
В главную подгруппу II группы входят бериллий Be, магний Mg,
кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов.
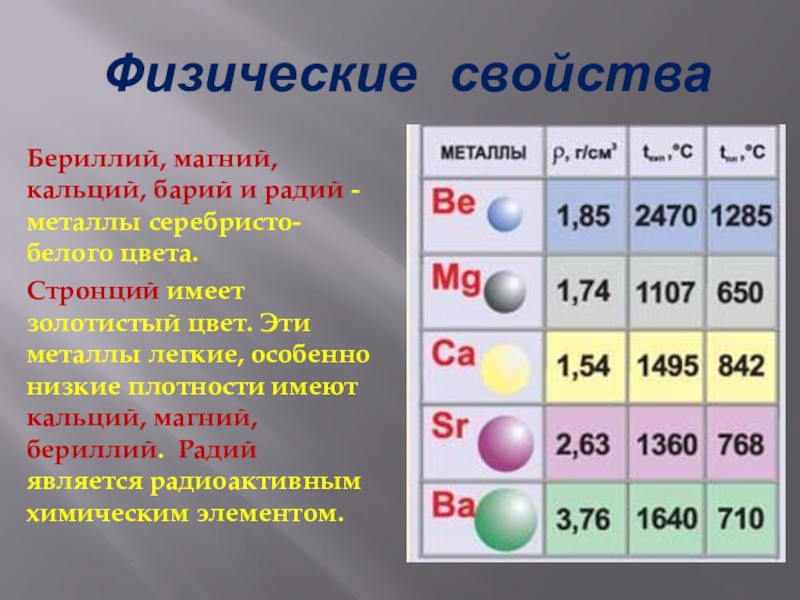
Слайд 6 Физические свойства
Бериллий, магний, кальций, барий и радий - металлы серебристо-белого
цвета.
Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.
Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.
Слайд 8Получение щелочноземельных металлов
Электролизом расплавов их хлоридов или термическим восстановлением их соединений:
BeF2
+ Mg = Be + MgF2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
Слайд 9Химические свойства
Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями.
Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
кальций
магний
бериллий
Слайд 10
Взаимодействие с простыми веществами
Все легко взаимодействуют с кислородом и
серой, образуя оксиды и сульфаты:
2Be + O2 = 2BeO
Ca + S = CaS
Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы - при обычных условиях.
Все металлы этой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами:
Ca + H2 = CaH2 (гидрид кальция)
3Mg + N2 = Mg3N2 (нитрид магния)
Ca + 2C = CaC2 (карбид кальция)
2Be + O2 = 2BeO
Ca + S = CaS
Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы - при обычных условиях.
Все металлы этой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами:
Ca + H2 = CaH2 (гидрид кальция)
3Mg + N2 = Mg3N2 (нитрид магния)
Ca + 2C = CaC2 (карбид кальция)
Слайд 11
Взаимодействие с кислотами
Все взаимодействуют с хлороводородной и разбавленной серной
кислотами с выделением водорода:
Be + 2HCl = BeCl2 + H2
Разбавленную азотную кислоту металлы восстанавливают главным образом до аммиака или нитрата аммония:
2Ca + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные металлы реагируют с этими кислотами.
Be + 2HCl = BeCl2 + H2
Разбавленную азотную кислоту металлы восстанавливают главным образом до аммиака или нитрата аммония:
2Ca + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные металлы реагируют с этими кислотами.
Слайд 12Взаимодействие со щелочами
Бериллий взаимодействует с водными растворами щелочей с образованием
комплексной соли и выделением водорода:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Остальные металлы II группы с щелочами не реагируют.
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Остальные металлы II группы с щелочами не реагируют.
Слайд 13Жесткость воды
Жёсткость воды - свойство воды (не мылиться, давать накипь в
паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния это параметр, показывающий содержание катионов кальция, магния в воде.
Жесткая вода образует накипь на стенках нагревательных котлов, батареях, чем существенно ухудшает их теплотехнические характеристики.
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
Жесткая вода образует накипь на стенках нагревательных котлов, батареях, чем существенно ухудшает их теплотехнические характеристики.
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
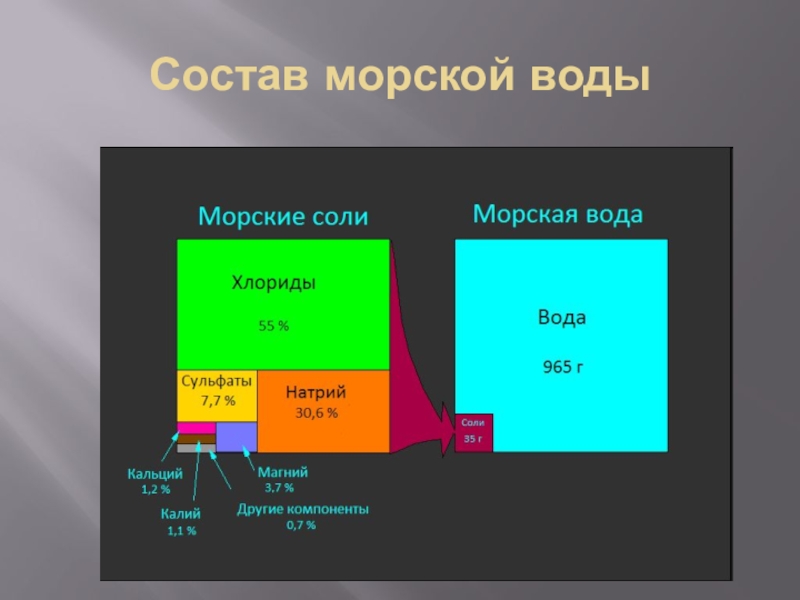
Слайд 15Жесткость воды
Существует два типа жесткости: временная и постоянная.
Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию. Временная жесткость связана с присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
Слайд 16Методы устранения жесткости
Для устранения карбонатной жёсткости воду кипятят. Общую жёсткость устраняют
или добавлением химических веществ, или при помощи так называемых катионитов. При использовании химического метода растворимые соли кальция и магния переводят в нерастворимые карбонаты, например добавляют известковое молоко и соду:
Са + 2НСО3 + Са + 2ОН = 2Н2О + 2СаСО3↓
Са + SO4 + 2Na + CO3 = 2Na + SO4 + CaCO3↓
Са + 2НСО3 + Са + 2ОН = 2Н2О + 2СаСО3↓
Са + SO4 + 2Na + CO3 = 2Na + SO4 + CaCO3↓
Слайд 17Кальций и его практическое значение.
Большая часть кальция содержится в составе силикатов
и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
кальцит
Изделия из гранита
Слайд 18Радий в природе
Радий довольно редок. За прошедшее с момента его открытия
время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226. Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468·109 лет)/(1602 года)=2,789·106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия или 1,02 мкг/т (кларк в земной коре).
Слайд 19Практическое значение
В начале века, после своего открытия, радий считался полезным и
включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средство для повышения тонуса и потенции.
Слайд 20Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе.
Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щелочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).