- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Металлы - общая характеристика.
Содержание
- 1. Металлы - общая характеристика.
- 2. Цели урока:Учащиеся должны знать: а) Значение термина «металл»; б)
- 3. История открытия металловКаменный векМедный век (IV –
- 4. План урока1. Ме - химический элемент.Положение в
- 5. План урока2. Ме – простое веществоМе связь.Сравнение
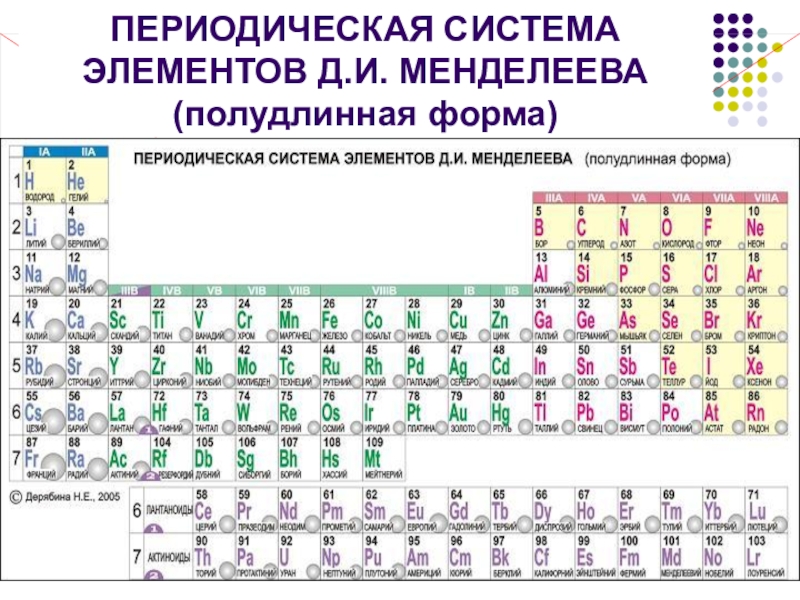
- 6. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (полудлинная форма)!!!
- 7. ВопросыПоложение в ПС.Особенности строения атома.Изменение Ме свойств в периоде и группе.Определение Ме как химического элемента.
- 8. Положение в ПСМеталлы занимают нижний левый угол
- 9. Особенности строения атомов Ме Большой радиус атома.
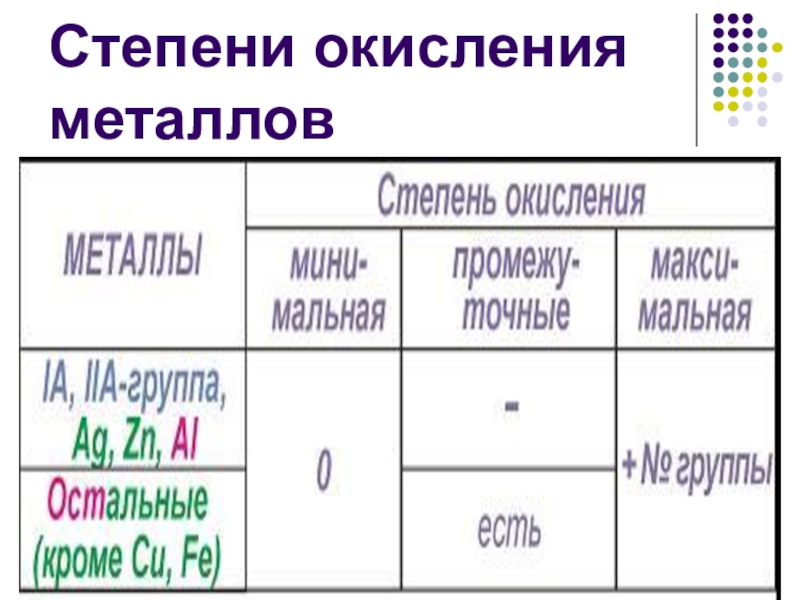
- 10. Степени окисления металлов
- 11. Изменение Ме свойств в периоде и группе.
- 12. Определение Ме как химического элемента. Атомы металлов
- 13. Металлическая связьМе0 – n ē ⇆ Men+
- 14. ? ОпределениеСвязь в металлах между атомами и ионами, образованная за счет обобществления электронов, называетсяметаллической.
- 15. На какой вид химической связи похожа металлическая
- 16. Металлическая связь характерна для…Чистых металловМеталлических сплавовТолько в жидком и твердом состоянии!
- 17. Металлическая кристаллическая решеткаВ узлах находятся ион-атомы связанные
- 18. Металлические кристаллические решеткиКубическая-объемноцентрированная (плотность упаковки 68%) Li,
- 19. Физические свойства металловЭлектропроводность, объясняется наличием свободных электронов
- 20. Физические свойства металловМеталлический блеск связан с плотной
- 21. Физические свойства металловТемпературы плавленияМе делятся на легкоплавкие(Тпл1000ºС)
- 22. Физические свойства металловТвердостьДля всех металлов (кроме ртути)
- 23. Физические свойства металловКовкость и пластичностьКовкость - ?Пластичность
- 24. Физические свойства металловПо отношению к магнитным полям
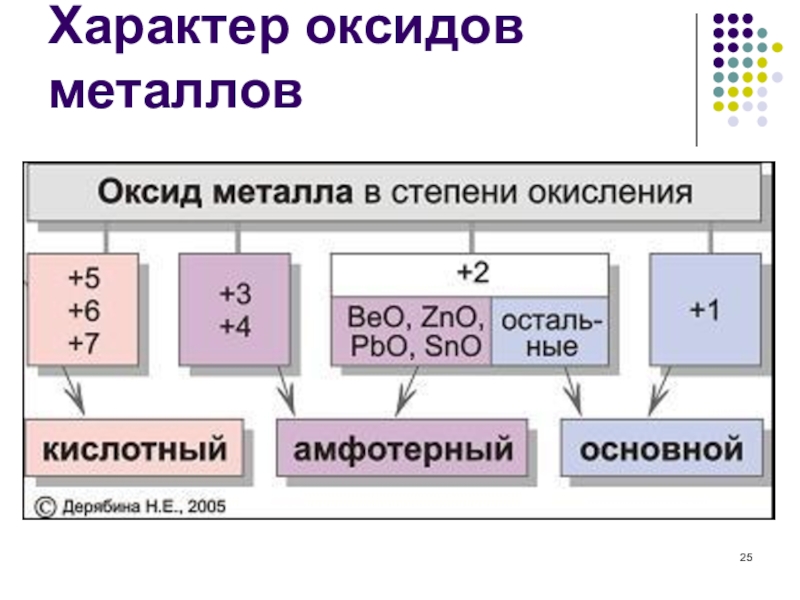
- 25. Характер оксидов металлов
- 26. Слайд 26
- 27. РтутьВольфрам
- 28. ТанталЛитийЦерий
- 29. СереброПлатинаЗолото
- 30. Уран
- 31. БериллийХромИндийНатрий
- 32. Тест 1) Какой металл при н.у. является
- 33. Выводы и итоги урока:Все металлы имеют металлическую
- 34. Д.З. § 47, дополнительный материал стр.210-213, задание 2 стр.213 Спасибо за внимание!
- 35. Д.З. § 35.2, № 1 стр.257 Спасибо за внимание!
Цели урока:Учащиеся должны знать: а) Значение термина «металл»; б) Строение металлов; в) Общие физические свойства металлов.Учащиеся должны уметь: а) Объяснять причины химических и физических свойств металлов; б) Проводить сравнения, делать выводы и обобщения; в) Составлять конспект урока.
Слайд 2Цели урока:
Учащиеся должны знать:
а) Значение термина «металл»;
б) Строение металлов;
в) Общие физические
свойства металлов.
Учащиеся должны уметь:
а) Объяснять причины химических и физических свойств металлов;
б) Проводить сравнения, делать выводы и обобщения;
в) Составлять конспект урока.
Учащиеся должны уметь:
а) Объяснять причины химических и физических свойств металлов;
б) Проводить сравнения, делать выводы и обобщения;
в) Составлять конспект урока.
Слайд 3История открытия металлов
Каменный век
Медный век (IV – III тысячелетия
до н.э.)
Бронзовый
век (конец IV – начало I тысячелетия до н.э.)
Железный век (I тысячелетие до н.э.)
Железный век (I тысячелетие до н.э.)
Слайд 4План урока
1. Ме - химический элемент.
Положение в ПС.
Особенности строения атома.
Изменение Ме
свойств в периоде и группе.
Определение Ме как химического элемента.
Определение Ме как химического элемента.
Слайд 5План урока
2. Ме – простое вещество
Ме связь.
Сравнение с другими химическими связями.
Ме
кристаллическая решетка.
Общие физические свойства Ме.
Объяснение физических свойств на основании строения кристаллической решетки.
Общие физические свойства Ме.
Объяснение физических свойств на основании строения кристаллической решетки.
Слайд 7Вопросы
Положение в ПС.
Особенности строения атома.
Изменение Ме свойств в периоде и группе.
Определение
Ме как химического элемента.
Слайд 8Положение в ПС
Металлы занимают нижний левый угол по диагонали B –
At, и все элементы побочных подгрупп.
Элементы металлы это все s- и d-элементы, а также некоторые p-элементы
Элементы металлы это все s- и d-элементы, а также некоторые p-элементы
Слайд 9Особенности строения атомов Ме
Большой радиус атома.
Небольшое число электронов (от
1 до 3) на внешнем уровне.
Слайд 11Изменение Ме свойств в периоде и группе.
В главной подгруппе:
число электронов на внешнем слое не изменяется
радиус атома увеличивается
металлические свойства усиливаются
В периоде:
заряд ядра увеличивается
радиус атома уменьшается
число электронов на внешнем слое увеличивается
металлические свойства ослабевают
радиус атома увеличивается
металлические свойства усиливаются
В периоде:
заряд ядра увеличивается
радиус атома уменьшается
число электронов на внешнем слое увеличивается
металлические свойства ослабевают
Слайд 12Определение Ме как химического элемента.
Атомы металлов легко отдают электроны внешнего (и
предвнешнего) электронного слоя, превращаясь в положительно заряженные ионы.
Ме0 – n e- = Ме n+
Ме0 – n e- = Ме n+
Слайд 14? Определение
Связь в металлах между атомами и ионами, образованная за счет
обобществления электронов, называется
металлической.
металлической.
Слайд 15На какой вид химической связи похожа металлическая связь?
Ионную связь (происходит образование
катионов, ē связывают ионы Ме за счет электростатического притяжения)
Ковалентную связь (основана на обобществлении ē)
Ковалентную связь (основана на обобществлении ē)
Слайд 16Металлическая связь характерна для…
Чистых металлов
Металлических сплавов
Только в жидком и твердом состоянии!
Слайд 17Металлическая кристаллическая решетка
В узлах находятся ион-атомы связанные металлической связью.
Между ион-атомами находятся
свободные электроны (электронный газ)
Расстояние между ион-атомами маленькое.
Расстояние между ион-атомами маленькое.
Слайд 18Металлические кристаллические решетки
Кубическая-объемноцентрированная (плотность упаковки 68%) Li, Na,
Кубическая-гранецентрированная (плотность упаковки
74%) Ca, Al,
Гексагональная (плотность упаковки 74%) Mg, Zn, Os
Гексагональная (плотность упаковки 74%) Mg, Zn, Os
Слайд 19Физические свойства металлов
Электропроводность, объясняется наличием свободных электронов (Ag, Cu, Au,
Al)
Сверхпроводимость возникает при низких температурах. Почему?
Теплопроводность (изменяется также как электропроводность)
(Ag, Cu, Au, Al)
Сверхпроводимость возникает при низких температурах. Почему?
Теплопроводность (изменяется также как электропроводность)
(Ag, Cu, Au, Al)
Слайд 20Физические свойства металлов
Металлический блеск связан с плотной упаковкой (Al, Ag, Pd)
Плотность
По плотности Ме делятся на
легкие(ρ<5 г/см3 ) и
тяжелые(ρ> 5 г/см3 )
Li (0,54 г/см3),Os (22,6 г/см3)
По плотности Ме делятся на
легкие(ρ<5 г/см3 ) и
тяжелые(ρ> 5 г/см3 )
Li (0,54 г/см3),Os (22,6 г/см3)
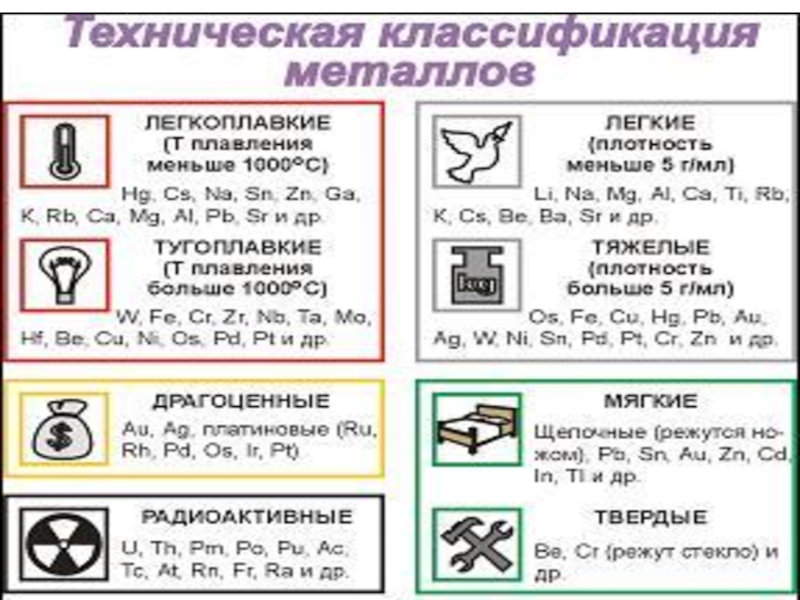
Слайд 21Физические свойства металлов
Температуры плавления
Ме делятся на легкоплавкие(Тпл1000ºС)
ТплCs =
28,4 ºС ТплHg = -38,9 ºС ТплW = 3390 ºС
Металлический звон («серебрянный» звон, «малиновый» звон)
Металлический звон («серебрянный» звон, «малиновый» звон)
Слайд 22Физические свойства металлов
Твердость
Для всех металлов (кроме ртути) при обычных условиях характерно
твердое агрегатное состояние.
Однако твердость их различна.
Наиболее твердые – металлы побочной подгруппы VI группы ПС.
Самые мягкие – металлы главной подгруппы I группы.
Самый твердый Cr (режет стекло)
Однако твердость их различна.
Наиболее твердые – металлы побочной подгруппы VI группы ПС.
Самые мягкие – металлы главной подгруппы I группы.
Самый твердый Cr (режет стекло)
Слайд 23Физические свойства металлов
Ковкость и пластичность
Ковкость - ?
Пластичность - ?
Для металлов возможен
сдвиг или смещение целых слоев атомов без нарушения химической связи.
Au, Ag, Cu, Sn, Pb, Fe,…
Au, Ag, Cu, Sn, Pb, Fe,…
Слайд 24Физические свойства металлов
По отношению к магнитным полям Ме делятся:
Ферромагнитные – способные
намагничиваться под действием даже слабых магнитных полей (Fe, Co, Ni)
Парамагнитные - способные намагничиваться под действием сильных магнитных полей (Al, Cr, Ti)
Диамагнитные – не притягиваются магнитом (Sn, Cu, Bi)
Парамагнитные - способные намагничиваться под действием сильных магнитных полей (Al, Cr, Ti)
Диамагнитные – не притягиваются магнитом (Sn, Cu, Bi)
Слайд 32Тест
1) Какой металл при н.у. является жидким?
А) Mg Б) Cd В)
Hg Г) Pb
2) Как называется кристаллическая решетка металлов?
А) атомная В) металлическая
Б) ионная Г) молекулярная
3) Какие металлы встречаются в природе только в виде соединений?
А) Ca, Mg Б) Hg, Cu В) Na, K Г) Al, Sc
4) Что обеспечивает металлам высокую электропроводность?
А) атомы металлов В) свободные электроны
Б) катионы Г) катионы и свободные электроны
5) Какой из перечисленных оксидов обладает амфотерными свойствами?
А) Na2O Б) CaO В) ZnO Г) CrО3
2) Как называется кристаллическая решетка металлов?
А) атомная В) металлическая
Б) ионная Г) молекулярная
3) Какие металлы встречаются в природе только в виде соединений?
А) Ca, Mg Б) Hg, Cu В) Na, K Г) Al, Sc
4) Что обеспечивает металлам высокую электропроводность?
А) атомы металлов В) свободные электроны
Б) катионы Г) катионы и свободные электроны
5) Какой из перечисленных оксидов обладает амфотерными свойствами?
А) Na2O Б) CaO В) ZnO Г) CrО3
Слайд 33Выводы и итоги урока:
Все металлы имеют металлическую кристаллическую решетку.
В металлах существует
металлическая связь.
Основные признаки металлов – металлический блеск, пластичность, электро- и теплопроводность.
Металлы проявляют только восстановительные свойства, потому что в реакциях они всегда отдают свои электроны.
Основные признаки металлов – металлический блеск, пластичность, электро- и теплопроводность.
Металлы проявляют только восстановительные свойства, потому что в реакциях они всегда отдают свои электроны.