- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Материалы к уроку металлическая химическая связь: Металлическая кристаллическая решетка
Содержание
- 1. Материалы к уроку металлическая химическая связь: Металлическая кристаллическая решетка
- 2. Химическая связь и строение вещества.Разные вещества имеют
- 3. Химическая связь и строение вещества.Результатом связывания атомов
- 4. Типы химической связи.Химическая связьковалентнаяионнаяметаллическаяводороднаяЯвляется причиной образованиябольшинствамолекул,молекулярныхионов,свободныхрадикалов иатомныхкристаллическихрешеток.Существуетвнутри молекулотдельных веществ,возникаетмежду молекуламинекоторыхвеществОбусловливаетсуществованиемолекул ионныхсоединений иионных кристаллических решетокСуществуетв простыхвеществах-металлах
- 5. Металлическая связь.Большинство металлов характеризуется небольшим числом электронов
- 6. Металлическая связь.В узлах кристаллической решетки металла наряду
- 7. Схема кристаллической решетки металлов.+++++++++++В узлах кристаллической решетки
- 8. Металлическая связь и физические свойства металлов.Металлическая
- 9. Пластичность. Пластичность металлов выражается в их способности
- 10. Электропроводность.Электропроводность металлов обусловлена наличием в них совокупности
- 11. Электрическое сопротивление вольфрама настолько велико,что он начинает
- 12. Теплопроводность.Теплопроводность металла объясняется высокой подвижностью электронов. Которые,
- 13. Металлический блеск.Гладкая поверхность металла или металлического изделия
- 14. Способность к образованию сплавов.Металлическая химическая связь и
- 15. Энергия кристаллических решеток некоторых металлов. Металл –
- 16. Литература.О.С.Габриелян «Химия 11 класс базовый уровень», учебник,
Слайд 2Химическая связь и строение вещества.
Разные вещества имеют разное строение.
Только благородные газы
Все другие вещества состоят из связанных атомов.
Химическая связь – электростатические силы, которые обусловливают связь между атомами.
Слайд 3Химическая связь и строение вещества.
Результатом связывания атомов является образование более сложных
Существование этих структур обусловлено различными типами химической связи.
Слайд 4Типы химической связи.
Химическая связь
ковалентная
ионная
металлическая
водородная
Является
причиной
образования
большинства
молекул,
молекулярных
ионов,
свободных
радикалов и
атомных
кристаллических
решеток.
Существует
внутри
молекул
отдельных
веществ,
возникает
между
молекулами
некоторых
веществ
Обусловливает
существование
молекул ионных
соединений
ионных кристаллических решеток
Существует
в простых
веществах-
металлах
Слайд 5Металлическая связь.
Большинство металлов характеризуется небольшим числом электронов на внешнем энергетическом уровне.
Все металлы в твердом состоянии имеют металлическую решетку. При ее образовании атомы сближаются до такой степени, что их вакантные орбитали начинают перекрываться. Валентный электрон при этом может относительно свободно перемещаться с орбитали своего атома на свободную и близкую по энергии орбиталь соседних атомов. Потеряв электрон, исходный атом теряет свою электронейтральность и превращается в катион, возможен и обратный процесс :
M - ne M
атом катион
o
n+
Слайд 6Металлическая связь.
В узлах кристаллической решетки металла наряду с нейтральными атомами присутствуют
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической.
Слайд 7Схема кристаллической решетки металлов.
+
+
+
+
+
+
+
+
+
+
+
В узлах кристаллической решетки металлов находятся положительные ионы
Электроны становятся общими и свободно перемещаются по решетке,
их называют свободными электронами или «электронным газом»
Слайд 8Металлическая связь и физические
свойства металлов.
Металлическая связь обусловливает важнейшие физические свойства
- теплопроводность;
- пластичность;
- металлический блеск.
Слайд 9Пластичность.
Пластичность металлов выражается в их способности деформироваться под действием механической
Пластичность металла объясняется тем, что под внешним воздействием одни слои ионов в кристаллах легко смещаются, как бы скользят друг относительно друга без разрыва связи между ними.
Кованая решетка Михайловского сада
Санкт-Петербург
Слайд 10Электропроводность.
Электропроводность металлов обусловлена наличием
в них совокупности подвижных электронов, которые под
Лучшими проводниками электрического тока являются серебро и медь, немного уступает алюминий.
Хуже всего электрический ток проводят марганец, свинец и ртуть, а также вольфрам и некоторые тугоплавкие металлы.
Слайд 11Электрическое сопротивление
вольфрама настолько велико,
что он начинает светиться при
прохождении через
электрического тока.
Это свойство вольфрама
используют для изготовления
нитей в лампах накаливания
Электропроводность.
Фонарь на Испанской лестнице в Риме.
Слайд 12Теплопроводность.
Теплопроводность металла объясняется высокой подвижностью электронов. Которые, сталкиваясь с колеблющимися в
С повышением температуры эти колебания ионов с помощью электронов передаются другим ионам и температура металла быстро выравнивается.
Слайд 13Металлический блеск.
Гладкая поверхность металла или металлического изделия имеет металлический блеск, который
Высокой светоотражательной способностью обладают ртуть, серебро, палладий и алюминий.
В порошке металлы , за исключением магния и алюминия теряют блеск, приобретая черную или серую окраску.
Музей Ватикана. «Мир»
Слайд 14Способность к образованию сплавов.
Металлическая химическая связь и металлическая кристаллическая решетка характерны
Металлические сплавы обладают нередко более полезными свойствами, чем составляющие их чистые металлы – повышенной прочностью, коррозионной стойкостью и твердостью( дюралюминий).
Медь плохо поддается литью, а оловянная бронза ( сплав меди и олова) имеет прекрасные литейные качества, из нее отливают художественные изделия.
Фрагмент бронзового подножия
Александровского столба, Санкт-Петербург
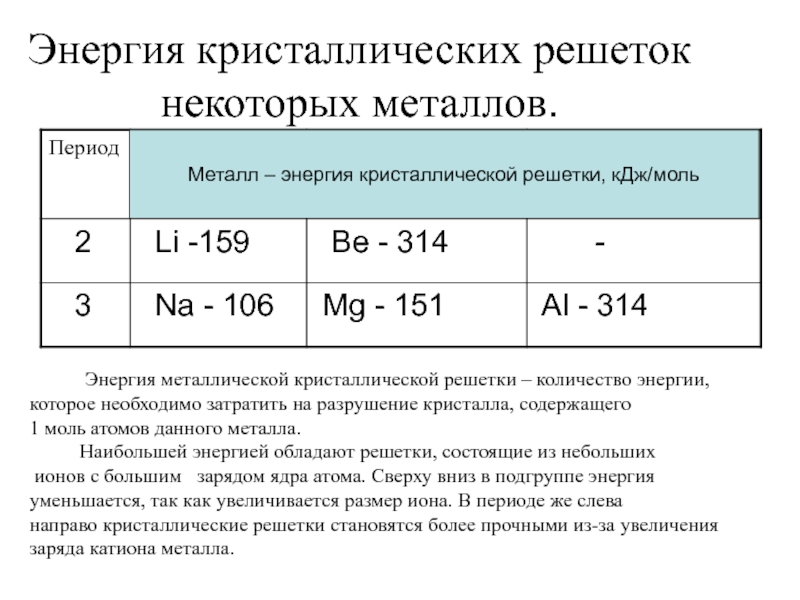
Слайд 15Энергия кристаллических решеток некоторых металлов.
Металл – энергия кристаллической решетки, кДж/моль
которое необходимо затратить на разрушение кристалла, содержащего
1 моль атомов данного металла.
Наибольшей энергией обладают решетки, состоящие из небольших
ионов с большим зарядом ядра атома. Сверху вниз в подгруппе энергия
уменьшается, так как увеличивается размер иона. В периоде же слева
направо кристаллические решетки становятся более прочными из-за увеличения
заряда катиона металла.
Слайд 16Литература.
О.С.Габриелян «Химия 11 класс базовый уровень», учебник, ООО Дрофа 2008
О.С. Габриелян,
А.С. Егоров « Репетитор по химии» ООО «Феникс», 2009
Н.Е.Кузьменко, В.В. Еремин, В.А. Попков « Учебное пособие по химии» школьный курс, ООО «Мир и образование» 2005 г.
Фото из семейного архива.