- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Материал к занятию : кристаллические решетки (презентация)
Содержание
- 1. Материал к занятию : кристаллические решетки (презентация)
- 2. Определение Кристаллическая решётка — вспомогательный геометрический образ, вводимый
- 3. Общая характеристикаСуществует огромное количество кристаллических структур. Их
- 4. Помимо основных трансляций, на которых строится элементарная
- 5. Характеристика металлической кристаллической решеткиВиды частиц – атомы-ионыСвязь
- 6. Молекулярная к\рВиды частиц – молекулыСвязь – Между
- 7. Атомная АтомыКовалентнаяАлмаз, кремний, бор, кварц. Твердые, нерастворимые,
- 8. Ионная Ионы (катионы и анионы)ИоннаяСоли, оксиды и
- 9. источникиhttp://www.1-klacc.ru/school-chemistry/chemistry-modelhttp://www.abdi.kz/index.php?action=products&id=97829&img=bighttp://meteo-hacker.narod.ru/NaCl.html
Определение Кристаллическая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. В зависимости от типов химической связи между узлами различают следующие типы
Слайд 2Определение
Кристаллическая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла.
Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. В зависимости от типов химической связи между узлами различают следующие типы решёток:
ионные,
атомные,
молекулярные,
металлические.
Решёткой является совокупность точек (атомов), которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с центрами молекул.
ионные,
атомные,
молекулярные,
металлические.
Решёткой является совокупность точек (атомов), которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с центрами молекул.
Слайд 3Общая характеристика
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического
состояния вещества — закономерное положение атомов в кристаллической решётке. Одно и то же вещество может кристаллизоваться в разных кристаллических решётках и обладать весьма различными свойствами (классический пример графит — алмаз). В случае простых веществ это явление называется аллотропией, в общем случае любых химических соединений — полиморфизмом. В то же время, разные вещества могут образовывать однотипные, или изоморфные, решётки, как, например, решётки многих металлов: меди, алюминия, серебра, золота. Иногда происходит замещение атомов в кристаллической решётке на атомы другого химического элемента с образованием твёрдого раствора.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Слайд 4Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке
могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (R) решётки Браве. Примитивная система трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1/3(a+b+c), —1/3(a+b+c)).
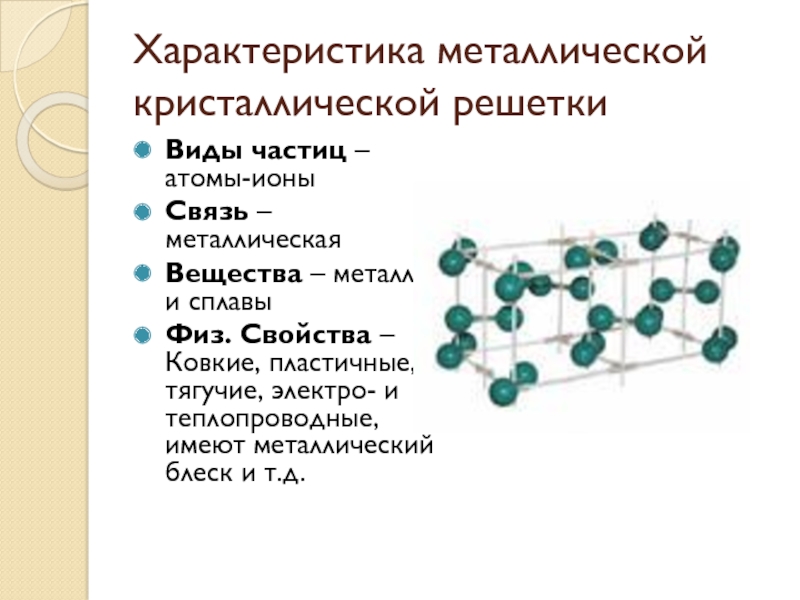
Слайд 5Характеристика металлической кристаллической решетки
Виды частиц – атомы-ионы
Связь – металлическая
Вещества –
металлы и сплавы
Физ. Свойства – Ковкие, пластичные, тягучие, электро- и теплопроводные, имеют металлический блеск и т.д.
Физ. Свойства – Ковкие, пластичные, тягучие, электро- и теплопроводные, имеют металлический блеск и т.д.
Слайд 6Молекулярная к\р
Виды частиц – молекулы
Связь – Между молекулами - слабые силы
межмолекулярного притяжения, а вот внутри молекул - прочная ковалентная связь
Примеры веществ – При обычных условиях газы или жидкости, или твердые вещества с низкой температурой плавления: органические вещества (нафталин), вода, углекислый газ и др.
Физ. Свойства – Легкоплавкие, летучие, в твердом виде хрупкие, способны к возгонке, имеют малую твердость
Примеры веществ – При обычных условиях газы или жидкости, или твердые вещества с низкой температурой плавления: органические вещества (нафталин), вода, углекислый газ и др.
Физ. Свойства – Легкоплавкие, летучие, в твердом виде хрупкие, способны к возгонке, имеют малую твердость
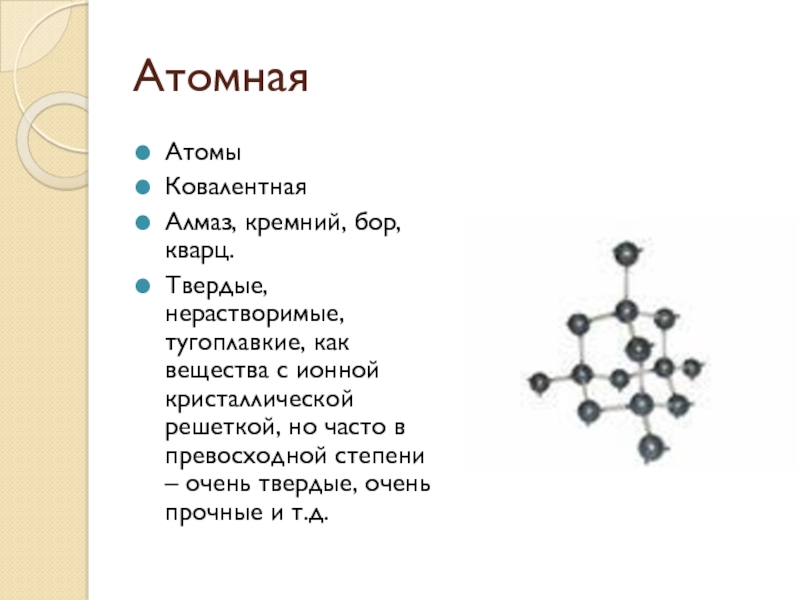
Слайд 7Атомная
Атомы
Ковалентная
Алмаз, кремний, бор, кварц.
Твердые, нерастворимые, тугоплавкие, как вещества с
ионной кристаллической решеткой, но часто в превосходной степени – очень твердые, очень прочные и т.д.
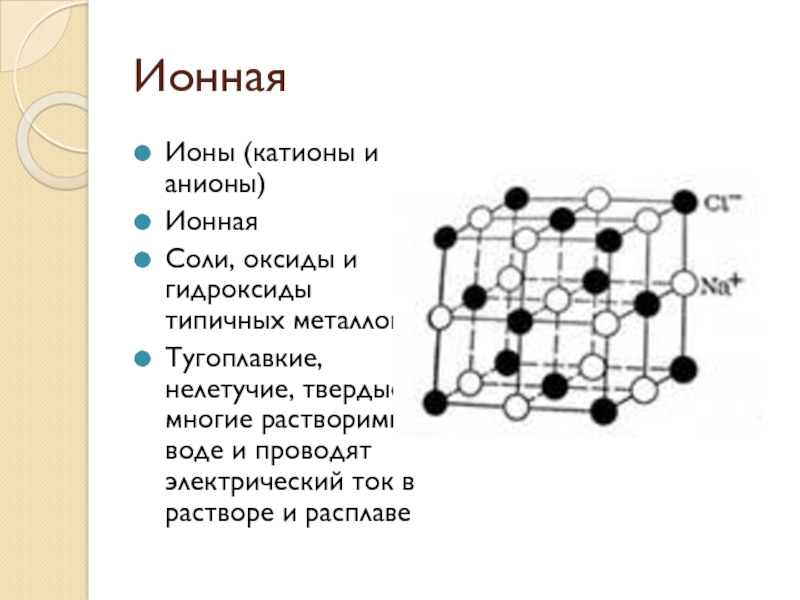
Слайд 8Ионная
Ионы (катионы и анионы)
Ионная
Соли, оксиды и гидроксиды типичных металлов
Тугоплавкие, нелетучие,
твердые, многие растворимы в воде и проводят электрический ток в растворе и расплаве