- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Материал к занятию : гидролиз (презентация 4)
Содержание
- 1. Материал к занятию : гидролиз (презентация 4)
- 2. ОпределениеГидролиз (от гидро... и греч. lýsis —
- 3. Правила гидролизаРавновесие в процессе Г. солей подчиняется
- 4. Если Г. подвергается соль, образованная слабой
- 5. Гидролиз соли сильной кислоты и слабого основания:CuCl2
- 6. Гидролиз соли слабой кислоты и слабого основания:Al2S3
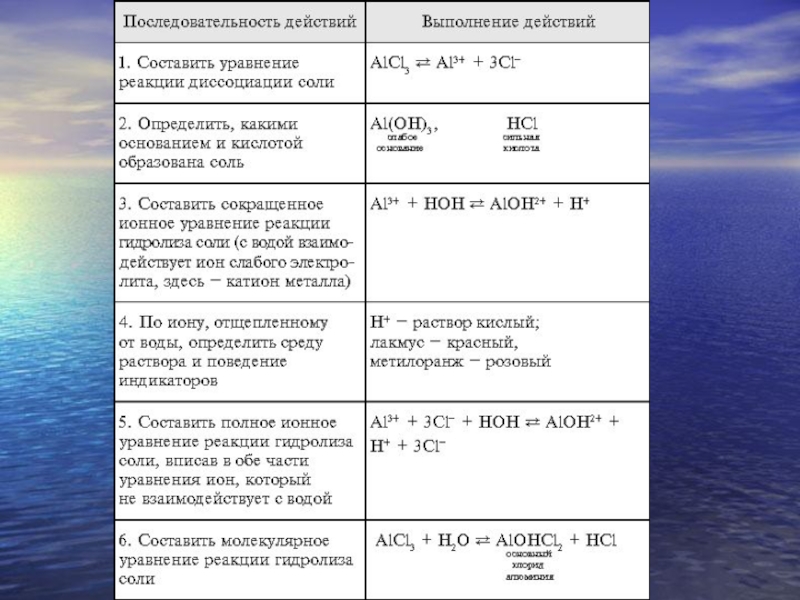
- 7. Слайд 7
- 8. Если заряд катиона (или аниона) соли
- 9. Гидролиз органических соединений Гидролиз органических соединений —
- 10. Степень гидролизаПод степенью гидролиза подразумевается отношение части
- 11. Применение Г. солей лежит в основе многих
- 12. http://www.xumuk.ru
ОпределениеГидролиз (от гидро... и греч. lýsis — разложение, распад), реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представить уравнением: где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты Г.
Слайд 2Определение
Гидролиз (от гидро... и греч. lýsis — разложение, распад), реакция ионного
обмена между различными веществами и водой. В общем виде Г. можно представить уравнением:
где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты Г.
где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты Г.
Слайд 3Правила гидролиза
Равновесие в процессе Г. солей подчиняется действующих масс закону. Если
в результате Г. образуется нерастворимое или легколетучее вещество, Г. идёт практически до полного разложения исходной соли. В остальных случаях Г. солей проходит тем полнее, чем слабее соответствующая соли кислота или основание.
Слайд 4 Если Г. подвергается соль, образованная слабой кислотой и сильным основанием,
например KCN, раствор имеет щелочную реакцию; это объясняется тем, что анион слабой кислоты частично связывает образовавшиеся при диссоциации воды ионы Н+ и в растворе остаётся избыток ионов OH.
NaOH-сильное основание
Н2СО3-слабая кислота
NaOH-сильное основание
Н2СО3-слабая кислота
Слайд 5
Гидролиз соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl
+ HCl
Cu2+ + Н2О = CuOH+ Н
Cu(OH)2-слабое основание
HCl-сильная кислота
(раствор имеет кислую среду, реакция протекает обратимо)
Cu2+ + Н2О = CuOH+ Н
Cu(OH)2-слабое основание
HCl-сильная кислота
(раствор имеет кислую среду, реакция протекает обратимо)
Слайд 6
Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3
+ 3H2S
Al(OH)3-слабое основание
H2S-слабая кислота
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
!!!Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Al(OH)3-слабое основание
H2S-слабая кислота
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
!!!Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Слайд 8 Если заряд катиона (или аниона) соли больше единицы, то Г.
часто приводит к образованию кислых (или основных) солей в качестве продуктов первой ступени процесса, например:
CuCl2 Cu (OH) Cl Cu (OH)2.
Количественной характеристикой Г. солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С a = 0,01%, а для ацетата аммония CH3COONH4 a = 0,5%. С повышением температуры и разбавлением раствора степень Г. увеличивается.
CuCl2 Cu (OH) Cl Cu (OH)2.
Количественной характеристикой Г. солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С a = 0,01%, а для ацетата аммония CH3COONH4 a = 0,5%. С повышением температуры и разбавлением раствора степень Г. увеличивается.
Слайд 9Гидролиз органических соединений
Гидролиз органических соединений — расщепление органического соединения
водой с образованием двух или более веществ. Обычно Г. осуществляется в присутствии кислот (кислотный Г.) или щелочей (щелочной Г.). Гидролитическому расщеплению чаще всего подвергаются связи атома углерода с другими атомами (галогенами, кислородом, азотом и др.). Так, щелочной Г. галогенидов служит методом получения (в том числе и промышленного) спиртов и фенолов, например:
Слайд 10Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к
общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Слайд 11Применение
Г. солей лежит в основе многих важных процессов в химической
промышленности и лабораторной практике. Частичный Г. трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент). Благодаря Г. возможно существование буферных систем, способных поддерживать постоянную кислотность среды. Такие растворы имеют и очень важное физиологическое значение — постоянная концентрация ионов Н+ необходима для нормальной жизнедеятельности организма. С Г. солей связан ряд геологических изменений земной коры и образование минералов, формирование природных вод и почв.
Гидролиз орг. соед. широко используется для получения глюкозы, этилового спирта, карбоновых кислот и др. Гидролиз жиров -основа пром. получения мыла и глицерина. Ферментативный гидролиз орг. соед. применяется в пищевой, текстильной, фармацевтич. пром-сти.
Гидролиз орг. соед. широко используется для получения глюкозы, этилового спирта, карбоновых кислот и др. Гидролиз жиров -основа пром. получения мыла и глицерина. Ферментативный гидролиз орг. соед. применяется в пищевой, текстильной, фармацевтич. пром-сти.