- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Мастер-класс Контроль знаний на уроках химии
Содержание
- 1. Мастер-класс Контроль знаний на уроках химии
- 2. Элементы и атомы,
- 3. Слайд 3
- 4. ТЕСТОВЫЙ КОНТРОЛЬ ЗНАНИЙ ПО ХИМИИТесты используются
- 5. Тест выборки представляет собой задания, включающие готовый
- 6. Тест дополнения представляет собой задание с пропуском
- 7. Тест группирования включает в себя перечень химических
- 8. Тест ранжирования представляет собой перечень (не более
- 9. Тест сличения превалирует в части В ЕГЭ
- 10. Тест напоминания требует от выполняющего ответа на
- 11. Альтернативные тестовые задания еще не включались в
- 12. Тема урока: «Физические и химические явления».Цель урока:
- 13. ЯвленияФизическиеХимическиеЯвление не сопровождается образованием новых веществ. Оно
- 14. Закрепление(устно) Тест напоминания.О каком явлении говорится
- 15. Признаки химических реакций:Изменение цвета;Изменение запаха;Выпадение (растворение) осадка;Выделение газа;Выделение (поглощение) теплоты.
- 16. Лабораторная работа.Цель: на практике изучить признаки
- 17. Правила техники безопасностиЧтобы не подвергать свою жизнь
- 18. Правила техники безопасностиВещества в лаборатории на вкус
- 19. Опыт 1. Горение лучины.
- 20. Опыт 2. Взаимодействие
- 21. Опыт 3. Взаимодействие щелочи
- 22. Опыт 4. Взаимодействие сульфата
- 23. Тест сличения.Установите признаки проделанных химических реакций:Взаимодействие сульфата
- 24. Тест группированияИз приведенного перечня явлений выберите те,
- 25. Тест дополнения (для слабых учащихся)Вставьте пропущенные слова.В
Слайд 2 Элементы и атомы, В менделеевский взятые круг Сделали химию
Г.Санников
Слайд 3
Kонтроль результатов обучения учащихся – неотъемлемая часть учебного процесса. Это сложный и многогранный процесс, важный и для учителя, и для учащихся. Kонтроль знаний стимулирует систематическую работу над учебным материалом и над собой, позволяет увидеть просчеты и достижения в методике преподавания. Во время контроля особенно удобно осуществлять дифференцированное обучение и индивидуальный подход к учащимся. Таким образом благодаря контролю знаний и умений школьников реализуется обратная связь от учеников к учителю, позволяющая оперативно регулировать ход учебного процесса.
Слайд 4ТЕСТОВЫЙ КОНТРОЛЬ
ЗНАНИЙ ПО ХИМИИ
Тесты используются в образовательном процессе уже около
В последние годы в связи с проведением в стране эксперимента по внедрению единого государственного экзамена (ЕГЭ) тестовые задания все чаще применяются учителями для контроля знаний, умений и навыков учеников. В химическом образовании могут быть использованы тестовые задания разного типа.
Слайд 5Тест выборки представляет собой задания, включающие готовый ответ, который учащиеся
Приведем примеры заданий такого теста.
1. Самый распространенный химический элемент в земной коре:
а) кремний; б) водород;
в) кислород; г) алюминий.
(Ответ. в.)
2. Число электронов на последнем энергетическом уровне в атоме азота равно:
а) 7; б) 14; в) 3; г) 5.
(Ответ. г.)
Слайд 6Тест дополнения представляет собой задание с пропуском знака, слова, цифры или
1. Молекула озона состоит из … атомов кислорода. (Ответ укажите цифрой.)
(Ответ. 3.)
2. Предельный одноатомный спирт, образующий с метанолом простой эфир состава С3Н8О, называется .................................... . (Запишите название спирта по систематической номенклатуре в соответствующем падеже.)
(Ответ. Этанолом.)
Слайд 7Тест группирования включает в себя перечень химических терминов или формул, которые
1. Из предложенного перечня выпишите формулы кислот:
СаО, Н2СО3, Сu(ОН)2, Н3РО4, NaHSO3,
H2O, HI, KNO3, Cl2O7, HNO3.
(Ответ. Н2СО3, Н3РО4, HI, HNO3.)
2. Выпишите в две колонки названия чистых веществ и смесей: морская вода, крахмал, сахар, молоко, серебро, уксусная кислота, туман, кислород.
Ответ.Чистые вещества:Kрахмал, сахар, серебро, уксусная кислота, кислород.
Смеси: Морская вода, молоко, туман.
Слайд 8Тест ранжирования представляет собой перечень (не более десяти) однопорядковых химических формул,
1. Расположите следующие химические элементы в порядке убывания радиусов их атомов:
K, Fr, Cs, Li, Na, Rb.
(Ответ. Fr, Cs, Rb, K, Na, Li.)
2. Расположите перечисленные вещества в ряд по мере усиления их кислотных свойств: фенол, этанол, 2,4,6-тринитрофенол.
(Ответ. Этанол, фенол, 2,4,6-тринитрофенол.)
Слайд 9Тест сличения превалирует в части В ЕГЭ по химии. Суть выполнения
1. По названию вещества установите, к какому классу неорганических веществ оно принадлежит.
1. Веселящий газ.
2. Поташ.
3. Kальцинированная сода.
4. Негашеная известь.
5. Едкое кали А. Kислоты.
Б. Соли.
В. Водородные соединения.
Г. Основания.
Д. Оксиды.
Е. Простые вещества.
Ж. Нитриды
(Ответ. 1 – Д, 2 – Б, 3 – Б, 4 – Д, 5 – Г.)
Слайд 10Тест напоминания требует от выполняющего ответа на поставленный вопрос. В части
Рассмотрим несколько примеров тестовых заданий этого типа.
1. Укажите число неспаренных электронов в возбужденном атоме углерода.
(Ответ. 4.)
2. Напишите формулу соли, образующейся при взаимодействии известковой воды с избытком углекислого газа.
(Ответ. Ca(HCO3)2.)
3. Kакова реакция среды раствора сульфата железа(III)?
(Ответ. Kислая.)
Слайд 11Альтернативные тестовые задания еще не включались в тесты ЕГЭ по химии,
Альтернативные тестовые задания с формой ответа в виде символов могут использоваться на уроках в графических диктантах по вариантам.
Слайд 12Тема урока: «Физические и химические явления».
Цель урока: познакомить учащихся
Научить отличать химические явления по признакам.
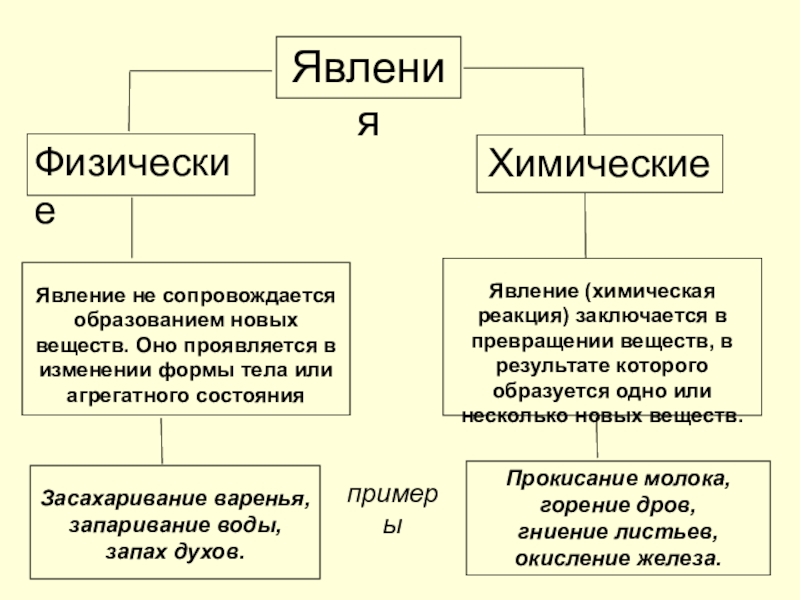
Слайд 13Явления
Физические
Химические
Явление не сопровождается образованием новых веществ. Оно проявляется в изменении формы
Явление (химическая реакция) заключается в превращении веществ, в результате которого образуется одно или несколько новых веществ.
Засахаривание варенья, запаривание воды,
запах духов.
Прокисание молока,
горение дров,
гниение листьев,
окисление железа.
примеры
Слайд 14Закрепление(устно)
Тест напоминания.
О каком явлении говорится в пословицах?
«Вода камень точит» _____________
«Железо
«Дождик вымочит, а красное солнышко высушит» ______________________
«Изподволь и сырые дрова загораются» ______
«От одного порченого яблока целый воз загнивает» ______________________
Слайд 15Признаки химических реакций:
Изменение цвета;
Изменение запаха;
Выпадение (растворение) осадка;
Выделение газа;
Выделение (поглощение) теплоты.
Слайд 17Правила техники безопасности
Чтобы не подвергать свою жизнь опасности,
Надо знать технику безопасности:
Делаешь
И при этом очень осторожно.
Сначала задачу реши теоретически,
Затем выполняй ее практически.
В химической лаборатории нельзя никогда
Голыми руками брать вещества.
Насыпаешь (наливаешь) вещества аккуратно,
Не высыпаешь (не выливаешь) вещества обратно.
С химическими веществами будь скупым -
Их количеством пользуйся небольшим.
Опыты делаешь тщательно
Над столом (лотком) обязательно.
Нельзя вдыхать пары и газы,
Если ты без противогаза.
Слайд 18Правила техники безопасности
Вещества в лаборатории на вкус не изучаются –
Это строго-настрого
Нельзя смешивать или сливать
Все химические вещества подряд.
С едкими веществами (кислоты, щелочи) работать можно,
Но крайне осторожно.
Если кислоты или щелочи на тебя попадают,
Их большим количеством воды немедленно смывают.
Кислоту в воду добавляют –
Только так кислоту разбавляют.
Если жидкость воспламеняется легко,
Работаешь с ней от огня далеко.
С приборами нагревательными
Работай очень внимательно.
На рабочем месте – порядок и чистота,
Правило это выполняешь всегда.
Слайд 19
Опыт 1. Горение лучины.
Зажгите спиртовку.внесите лучину в
Слайд 20Опыт 2. Взаимодействие
мрамора
Положите в пробирку 1-2 кусочка мрамора. Прилейте столько соляной кислоты, чтобы ею покрылись кусочки. Что наблюдаете? Образовалось ли новое вещество? Какой признак химической реакции вы наблюдали?
Слайд 21Опыт 3. Взаимодействие щелочи
В пробирку налейте 2 мл щелочи NaOH, добавьте несколько капель фенолфталеина. Что наблюдаете? О чем говорит изменение окраски?
Прилейте в эту пробирку осторожно немного раствора кислоты HCl. Что наблюдаете? Что наблюдаете? Какими внешними признаками сопровождались эти реакции?
Слайд 22Опыт 4. Взаимодействие сульфата
В пробирку налейте 2 мл раствора сульфата
меди(II) CuSO4 и добавьте 1 мл щелочи NaOH. Что наблюдаете? К полученному осадку приливайте по каплям раствор кислоты HCl, пробирку осторожно встряхивайте.
Слайд 23Тест сличения.
Установите признаки проделанных химических реакций:
Взаимодействие сульфата меди(II) со щелочью.
Взаимодействие мрамора
Взаимодействие щелочи с индикатором.
Горение лучины.
А. Выпадение (растворение) осадка;
Б. Изменение цвета;
В. Выделение газа;
Г. Выделение теплоты.
Слайд 24Тест группирования
Из приведенного перечня явлений выберите те, которые относятся к физическим:
а)
б) при пропускании через воду электрического тока образуются два газа – водород и кислород;
в) при работе автомобильного двигателя бензин испаряется;
г) гашение соды раствором лимонной кислоты;
д) таяние льда.
Слайд 25Тест дополнения (для слабых учащихся)
Вставьте пропущенные слова.
В результате _______ явления образуется
новое
На медных предметах образуется зеленый налет. Это _______ явление.
Плавление металлов относится к ________ явлениям.
Испарение спирта - это ________ явление.