- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Лабораторная работа по теме Карбоновые кислоты- химические свойства
Содержание
- 1. Лабораторная работа по теме Карбоновые кислоты- химические свойства
- 2. Перед началом эксперимента внимательно ознакомьтесь с инструкциями
- 3. Цель работы: Объяснить химические свойства карбоновых кислот.Реактивы
- 4. Таблица Сделайте общий вывод о проделанной работе.
- 5. Опыт 1. Получение уксусной кислоты.В пробирку с
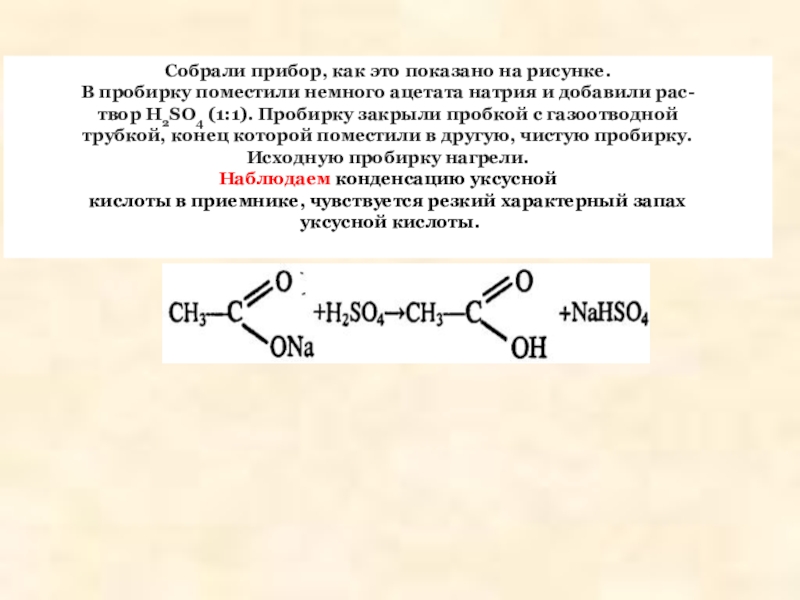
- 6. Собрали прибор, как это показано на рисунке.
- 7. Опыт 2б. Взаимодействие уксусной кислоты с металлами.Посмотрите
- 8. Во вторую пробирку добавили немного порошка магния,
- 9. Опыт 2а. Свойства карбоновых кислот.Посмотрите видео-опыт «Взаимодействие
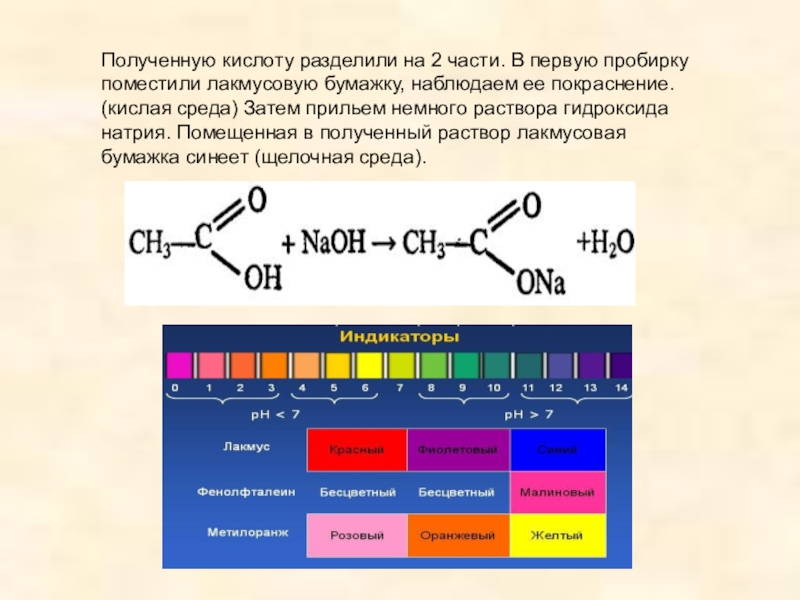
- 10. Полученную кислоту разделили на 2 части. В
- 11. Опыт 2в. Взаимодействие уксусной кислоты с солями
- 12. 1).Na2CO3 + 2 CH3COOH ---> 2CH3COONa +
- 13. Опыт 3. Получение уксусно- этилового эфираПосмотрите видео-опыт
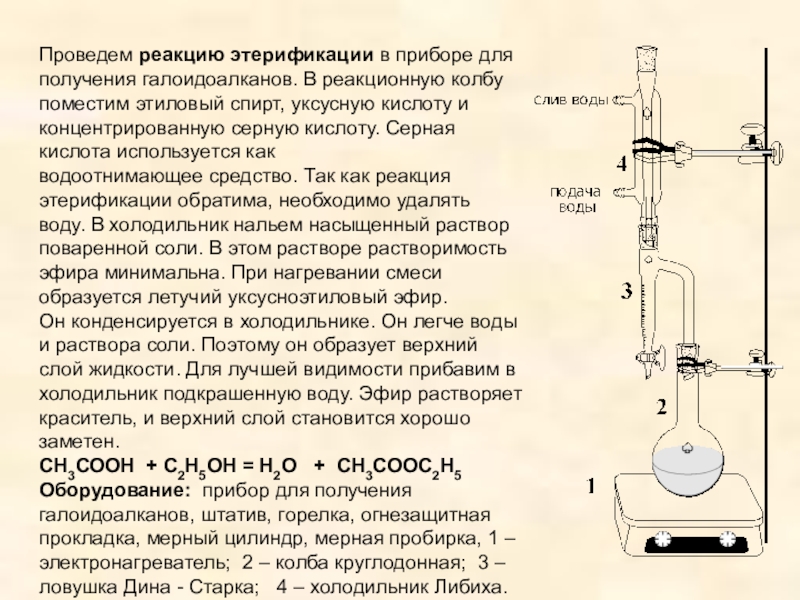
- 14. Проведем реакцию этерификации в приборе для получения
- 15. УРОК ОКОНЧЕН СПАСИБО ЗА УРОК
Слайд 3Цель работы: Объяснить химические свойства карбоновых кислот.
Реактивы и оборудование: ацетат натрия,
Слайд 5
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1-
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Ход работы
Слайд 6Собрали прибор, как это показано на рисунке. В пробирку поместили немного ацетата
Наблюдаем конденсацию уксусной кислоты в приемнике, чувствуется резкий характерный запах
уксусной кислоты.
Слайд 7Опыт 2б. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Слайд 8Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа. Составьте
Взаимодействие уксусной кислоты с металлами
Уксусной кислоте, как и неорганическим кислотам, присущи общие свойства кислот. Убедимся в том, что эта кислота способна реагировать с металлами. В две пробирки поместим кусочки магния и цинка. Прильем к ним раствор уксусной кислоты. В пробирке с магнием идет энергичная реакция – выделяется водород. В пробирке с цинком, менее активным металлом, выделение водорода едва заметно.
2СН3СООН + Мg = H2 + ( CH3COO)2 Mg
2СН3СООН + Zn = H2 + ( CH3COO)2 Zn
При взаимодействии металлов с раствором уксусной кислоты образуется водород и соли уксусной кислоты. Соли уксусной кислоты называются ацетатами.
Оборудование: штатив для пробирок, пробирка, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с кислотами.
Слайд 9Опыт 2а. Свойства карбоновых кислот.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями»
В
Что наблюдаете?
Почему?
Почему происходит
обесцвечивание?
Запишите УХР,
назовите продукты.
Слайд 10Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку,
Слайд 11Опыт 2в. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
Посмотрите видео-опыт
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
1).Na2CO3 + 2 CH3COOH ---> 2CH3COONa + H2O + CO2
2Na(+) + CO3(-2) + 2 CH3COO(-) +2H(+) ---> 2CH3COO(-) +2Na(+) + H2O + CO2 CO3(-2) +2H(+) ---> H2O + CO2
Слайд 121).Na2CO3 + 2 CH3COOH ---> 2CH3COONa + H2O + CO2 2Na(+)
Уксусная кислота – слабая кислота, однако она способна вытеснять более слабые кислоты из их солей, например, из солей угольной кислоты. Приготовим пробирку с раствором карбоната натрия, приливаем уксусную кислоту, начинается реакция с выделением углекислого газа, так как в растворе появилась угольная кислота. Она неустойчива и разлагается на углекислый газ и воду. Уксусная кислота вытеснила угольную кислоту из ее соли.
Слайд 13Опыт 3. Получение уксусно- этилового эфира
Посмотрите видео-опыт «Получение уксусно- этилового эфира»
В
Запишите УХР, назовите продукты.
Слайд 14Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу
Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
СН3СООН + С2Н5ОН = H2О + CH3COOС2Н5
Оборудование: прибор для получения галоидоалканов, штатив, горелка, огнезащитная прокладка, мерный цилиндр, мерная пробирка, 1 – электронагреватель; 2 – колба круглодонная; 3 – ловушка Дина - Старка; 4 – холодильник Либиха.