- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему КРЕМНИЙ (Si). Материалы к уроку
Содержание
- 1. КРЕМНИЙ (Si). Материалы к уроку
- 2. СодержаниеОсновная информацияРаспространение в природеОбщая характеристикаОсобенностиРеакцииПолучение 1\2\3ПрименениеПо типу
- 3. Основная информация Кремний (лат. Silicium), Si,
- 4. Распространение в природе Кремний после
- 5. Общая
- 6. Особенности Обладая малой величиной электроотрицательности,
- 7. Реакции В кислороде окисляется начиная
- 8. Получение 1 Наиболее простым и
- 9. Получение 2 К. технической чистоты (95—98%)
- 10. Получение 3 Путём хлорирования
- 11. Применение Специально легированный К. широко
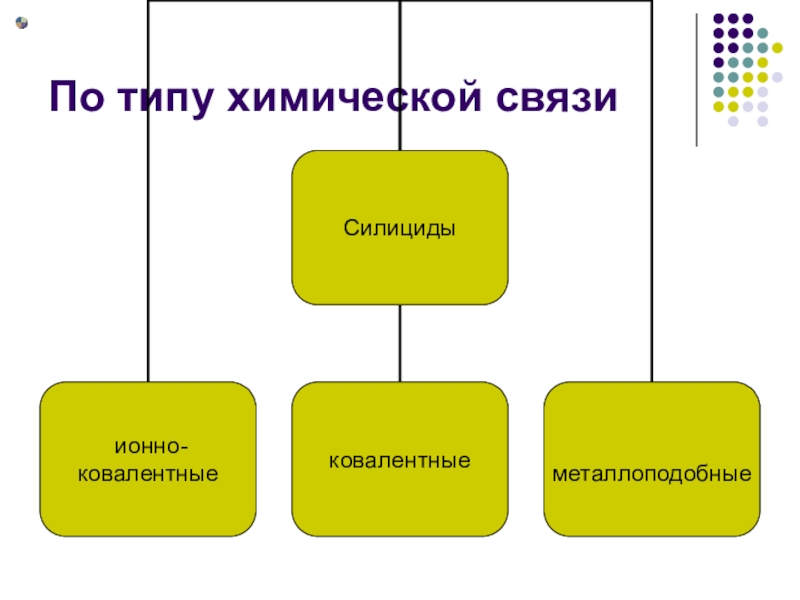
- 12. По типу химической связи
- 13. Применение силицидов С. используются в
- 14. Силицированный графит Силицированный графит, графит,
- 15. Силумин Силумин (от
- 16. Силикохром Силикохром, ферросиликохром, ферросплав,
- 17. Кремния галогениды Кремния
- 18. Карбид кремния Кремния карбид,
- 19. Кремния Диоксид Кремния
- 20. Кремниевые кислоты Кремниевые
- 21. Силикаты
- 22. Слайд 22
- 23. Приложение 2
- 24. Приложение 3
- 25. Приложение 4
СодержаниеОсновная информацияРаспространение в природеОбщая характеристикаОсобенностиРеакцииПолучение 1\2\3ПрименениеПо типу химической связиПрименение силицидовСилицированный графитСилуминСиликохромКремния галогенидыКарбид кремния Кремния ДиоксидКремниевые кислотыСиликатыПриложение 1\2\3\4
Слайд 2Содержание
Основная информация
Распространение в природе
Общая характеристика
Особенности
Реакции
Получение 1\2\3
Применение
По типу химической связи
Применение силицидов
Силицированный графит
Силумин
Силикохром
Кремния
галогениды
Карбид кремния
Кремния Диоксид
Кремниевые кислоты
Силикаты
Приложение 1\2\3\4
Карбид кремния
Кремния Диоксид
Кремниевые кислоты
Силикаты
Приложение 1\2\3\4
Слайд 3Основная информация
Кремний (лат. Silicium), Si, химический элемент IV группы
периодической системы Менделеева; атомный номер 14, атомная масса 28,086. В природе элемент представлен тремя стабильными изотопами: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Слайд 4Распространение в природе
Кремний после кислорода – самый
распространённый элемент (27,6%) на земле. Это элемент, который входит в большинство минералов и горных пород, составляющих твёрдую оболочку земной коры. В земной коре К. играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии К. важна исключительно прочная связь его с кислородом. Наиболее широко распространённые соединения кремния – оксид кремния SiO2 и производные кремниевых кислот, называемые силикатами
Слайд 5 Общая характеристика
К. образует тёмно-серые с металлическим блеском
кристаллы, имеющие кубическую
гранецентрированную решётку типа алмаза
с периодом а = 5,431Å,
плотностью 2,33 г/см3.
При очень высоких
давлениях получена
новая модификация
с плотностью 2,55 г/см3.
К. плавится при 1417°С,
кипит при 2600°С.
кристаллы, имеющие кубическую
гранецентрированную решётку типа алмаза
с периодом а = 5,431Å,
плотностью 2,33 г/см3.
При очень высоких
давлениях получена
новая модификация
с плотностью 2,55 г/см3.
К. плавится при 1417°С,
кипит при 2600°С.
Слайд 6Особенности
Обладая малой величиной электроотрицательности, равной 1,8 (против 2,5
у углерода; 3,0 у азота и т. д.), К. в соединениях с неметаллами электроположителен, и эти соединения носят полярный характер. Большая энергия связи с кислородом Si—O, равная 464 кдж/моль (111 ккал/моль), обусловливает стойкость его кислородных соединений (SiO2 и силикатов). Энергия связи Si—Si мала, 176 кдж/моль (42 ккал/моль); в отличие от углерода, для К. не характерно образование длинных цепей и двойной связи между атомами Si.
Слайд 7Реакции
В кислороде окисляется начиная с 400°С, образуя кремния
двуокись SiO2. Известна также моноокись SiO, устойчивая при высоких температурах в виде газа; в результате резкого охлаждения может быть получен твёрдый продукт, легко разлагающийся на тонкую смесь Si и SiO2. К. устойчив к кислотам и растворяется только в смеси азотной и фтористоводородной кислот; легко растворяется в горячих растворах щелочей с выделением водорода. К. реагирует с фтором при комнатной температуре, с остальными галогенами — при нагревании с образованием соединений общей формулы SiX4
Слайд 8Получение 1
Наиболее простым и удобным лабораторным способом получения
кремния является восстановление оксида кремния SiO2 при высоких температурах металлами-востановителями. Вследствие устойчивости оксида кремния для восстановления применяют такие активные восстановители, как магний и алюминий:
3SiO2 + 4Al = 3Si + 2Al2O3
3SiO2 + 4Al = 3Si + 2Al2O3
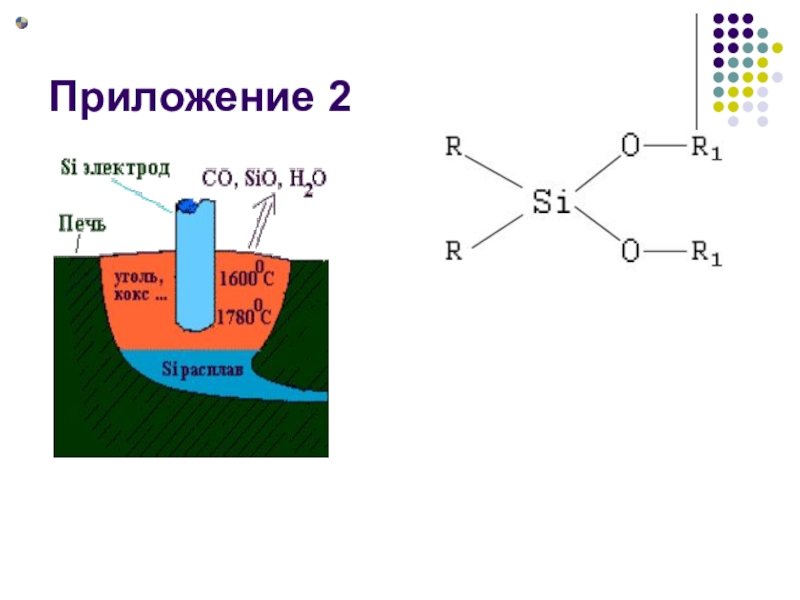
Слайд 9Получение 2
К. технической чистоты (95—98%) получают в электрической дуге
восстановлением кремнезёма SiO2 между графитовыми электродами.
SiO2+2C=Si+2CO
Чистый полупроводниковый К. получают в двух видах: поликристаллический (восстановлением SiCI4 или SiHCl3 цинком или водородом, термическим разложением Sil4 и SiH4) и монокристаллический (бестигельной зонной плавкой и “вытягиванием” монокристалла из расплавленного К. — метод Чохральского).
SiO2+2C=Si+2CO
Чистый полупроводниковый К. получают в двух видах: поликристаллический (восстановлением SiCI4 или SiHCl3 цинком или водородом, термическим разложением Sil4 и SiH4) и монокристаллический (бестигельной зонной плавкой и “вытягиванием” монокристалла из расплавленного К. — метод Чохральского).
Слайд 10Получение 3
Путём хлорирования технического кремния получают тетрахлорид
кремния. Старейшим методом разложения тетрахлорида кремния является метод выдающегося русского химика академика Н.Н.Бекетова. Метод этот можно представить уравнением:
SiCl4+Zn=Si+2ZnCl2.
Здесь пары тетрахлорида кремния, кипящего при температуре 57,6°C, взаимодействуют с парами цинка.
В настоящее время тетрахлорид кремния восстанавливают водородом. Реакция протекает по уравнению:
SiCl4+2Н2=Si+4НCl.
SiCl4+Zn=Si+2ZnCl2.
Здесь пары тетрахлорида кремния, кипящего при температуре 57,6°C, взаимодействуют с парами цинка.
В настоящее время тетрахлорид кремния восстанавливают водородом. Реакция протекает по уравнению:
SiCl4+2Н2=Si+4НCl.
Слайд 11Применение
Специально легированный К. широко применяется как материал для
изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, управляемые диоды — тиристоры; солнечные фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку К. прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике
Слайд 13Применение силицидов
С. используются в составе жаропрочных металлокерамических композиционных
материалов для авиационной и ракетной техники. MoSi2 служит для производства нагревателей печей сопротивления, работающих на воздухе при температуре до 1600 °С. FeSi2, Fe3Si2, Fe2Si входят в состав ферросилиция, применяемого для раскисления и легирования сталей. Карбид кремния — один из полупроводниковых материалов.
Слайд 14Силицированный графит
Силицированный графит, графит, насыщенный кремнием. Производится
обработкой пористого графита в кремниевой засыпке при 1800—2200 °С (при этом пары кремния осаждаются в порах). Состоит из графитовой основы, карбида кремния и свободного кремния. Сочетает свойственную графиту высокую термостойкость и прочность при повышенных температурах с плотностью, газонепроницаемостью, высокой стойкостью к окислению при температурах до 1750°С и эрозионной стойкостью
Слайд 15
Силумин
Силумин (от лат. Silicium — кремний и Aluminium
— алюминий), общее название группы литейных сплавов на основе алюминия, содержащих кремний (4—13%, в некоторых марках до 23%). В зависимости от желательного сочетания технологических и эксплуатационных свойств С. легируют Cu, Mn, Mg, иногда Zn, Ti, Be и другими металлами. С. обладают высокими литейными и достаточно высокими механическими свойствами, уступая, однако, по механическим свойствам литейным сплавам на основе системы Al — Cu. К достоинствам С. относится их повышенная коррозионная стойкость во влажной и морской атмосферах.
Слайд 16Силикохром
Силикохром, ферросиликохром, ферросплав, основные компоненты которого
— кремний и хром; выплавляется в рудно-термической печи углевосстановительным процессом из кварцита и гранулированного передельного феррохрома или хромовой руды. С. с 10—46% Si (остальное Cr, Fe и примеси) используется при выплавке низколегированной стали, а также для получения феррохрома с пониженным содержанием углерода силикотермическим процессом.
Слайд 17
Кремния галогениды
Кремния галогениды, соединения кремния с галогенами. Известны
К. г. следующих типов (Х-галоген): SiX4, SiHnX4-n (галогенсиланы), SinX2n+2 и смешанные галогениды, например SiClBr3. При обычных условиях SiF4 — газ, SiCl4 и SiBr4 — жидкости (tпл — 68,8 и 5°С), SiI4 — твёрдое тело (tnл 124°С). Соединения SiX4 легко подвергаются гидролизу: SiX4+2H2O=SiO2+4HX; на воздухе дымят вследствие образования очень мелких частиц SiO2; тетрафторид кремния реагирует иначе: 3SiF4+2H2O=SiO2+2H2SiF6. Хлорсиланы (SiHnX4-n), например SiHCl3 (получается действием газообразного HCl на Si), при действии воды образуют полимерные соединения с прочной силоксановой цепью Si—O—Si.
Слайд 18Карбид кремния
Кремния карбид, карборунд, SiC, соединение кремния
с углеродом; один из важнейших карбидов, применяемых в технике. В чистом виде К. к. — бесцветный кристалл с алмазным блеском; технический продукт зелёного или сине-чёрного цвета. К. к. существует в двух основных кристаллических модификациях — гексагональной (a-SiC) и кубической (b-SiC),”. Слои из атомов углерода и кремния в a-SiC размещены относительно друг друга по-разному, образуя много структурных типов. Переход b-SiC в a-SiC происходит при температуре 2100—2300°С. К. к. тугоплавок, имеет исключительно высокую твёрдость, уступая только алмазу и бора карбиду B4C; хрупок; плотность 3,2 г/см3.
Слайд 19
Кремния Диоксид
Кремния диоксид (кремнезем), SiO2, кристаллы. Наиболее распространенный
минерал — кварц; обычный песок — также кремния диоксид. Используют в производстве стекла, фарфора, фаянса, бетона, кирпича, керамики, как наполнитель резины, адсорбент в хроматографии, в электронике, акустооптике и др. Кремнезёма минералы, ряд минеральных видов, представляющих собой полиморфные модификации двуокиси кремния; устойчивы при определённых интервалах температуры в зависимости от давления.
Слайд 20
Кремниевые кислоты
Кремниевые кислоты, производные кремниевого ангидрида SiO2; очень
слабые кислоты, мало растворимые в воде. В чистом виде были получены метакремниевая кислота H2SiO3 (точнее её полимерная форма H8Si4O12) и H2Si2O5. Аморфная двуокись кремния (аморфный кремнезём) в водном растворе (растворимость около 100 мг в 1 л) образует преимущественно ортокремниевую кислоту H4SiO4.
Кремнефтористоводородная кислота, H2SiF6, сильная неорганическая кислота.
Кремнефтористоводородная кислота, H2SiF6, сильная неорганическая кислота.
Слайд 21
Силикаты
Силикаты, соли кислот кремния. Наиболее широко распространены в
земной коре (80% по массе); известно более 500 минералов, среди них – драгоценные камни, например изумруд, берилл, аквамарин. Силикаты – основа цементов, керамики, эмалей, силикатного стекла; сырье в производстве многих металлов, клеев, красок и др.; материалы радиоэлектроники и т.д. Кремнефториды, фторсиликаты, соли кремнефтористоводородной кислоты H2SiF6. При нагревании распадаются, например CaSiF6 = CaF2 + SiF4.