- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Коррозия металлов
Содержание
- 1. Коррозия металлов
- 2. Тема: Коррозия металловЦели урока: Сформировать понятие «коррозия
- 3. Тема: «Коррозия металлов» Эпиграф: «Высокая цель человека
- 4. Слайд 4
- 5. Виды коррозии 1. Химическая коррозия — взаимодействие металлов с
- 6. Электрохимическая коррозия оцинкованного железа (Fe/Zn)
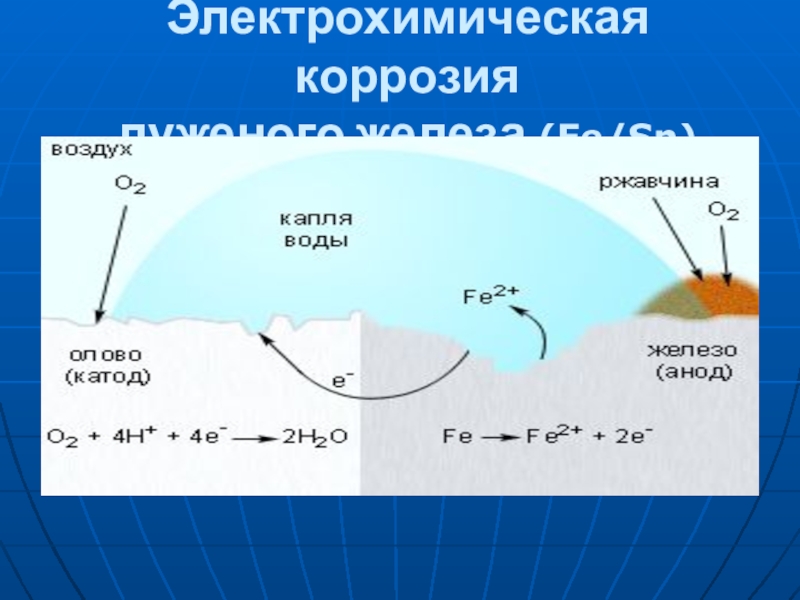
- 7. Электрохимическая коррозия луженого железа (Fe/Sn)
- 8. Упражнение Пары металлов, находящиеся в тесном контакте, погружены
- 9. Коррозия - это вред Коррозия металлов наносит большой
- 10. Почему с коррозией нужно бороться? Коррозия приводит
- 11. Способы защиты металлов от коррозии
- 12. 1. Полировка Механическая полировка металлов
- 13. 2. Покрытия А) Неметаллические (лаки, краски)
- 14. Антикоррозионная «броня» современного автомобиля должна состоять из слоев:
- 15. Применение цинкового покрытия в автомобильной промышленности Существует два
- 16. 3. Электрохимическая защитаА) Протекторная защита– к конструкции
- 17. Б) Катодная защита – поверхность
- 18. 4. Использование нержавеющих сталей Легирующие
- 19. Самостоятельная работа
- 20. Ответы1. б, а2. Куба, т.к. это
- 21. Домашняя работаЛитература: Ерохин М.Ю. «Химия» с. 179 - 184
- 22. Урок окончен, спасибо за внимание
- 23. Коррозия металлов Подготовил: преподаватель химии ГБОУ СПО
Слайд 1Заполните пропуски в тексте:
1. По активности металлов вступать в реакции металлы
2. В чистом виде в природе встречаются металлы, находящиеся в ряду напряжения ____.
3. Атомы металлов в химических реакциях могут только ____ (отдавать/принимать) электроны, поэтому они являются _____ (окислителями/восстановителями).
4. Большинство металлов находится в природе в виде ____.
Слайд 2Тема: Коррозия металлов
Цели урока:
Сформировать понятие «коррозия металлов»
2. Рассмотреть виды
3. Ознакомиться со способами защиты металлов от коррозии
Слайд 3Тема: «Коррозия металлов»
Эпиграф:
«Высокая цель человека науки – проникать в самую
Р.Ролан
Слайд 4
Сущность коррозии металлов
Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой.
Наиболее часто при коррозии металл окисляется с образованием катионов металла, которые при дальнейших превращениях дают различные продукты коррозии (оксиды, соли и др.).
Слайд 5Виды коррозии
1. Химическая коррозия — взаимодействие металлов с сухими газами или жидкостями,
Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 3Fe + 2O2 → Fe3O4
2. Электрохимическая коррозия — разрушение более активного металла при контакте двух разнородных металлов в присутствии электролита (конденсат, дождевая вода и т. д.).
Какой вид коррозии наиболее распространен в
естественных условиях?
Слайд 6Электрохимическая коррозия
оцинкованного железа (Fe/Zn)
анод
Zn - 2ē →
восстановитель
катод
В кислой среде
2Н+ + 2ē → Н2↑
окислитель
В нейтральной среде
О2 + 2Н2О + 4ē → 4ОН-
окислитель
Слайд 8Упражнение
Пары металлов, находящиеся в тесном контакте, погружены в раствор электролита.
Укажите какой
a) Cr/ Fe b) Mn/Cu
c) Ni/ Fe d) Fe/Cu
Слайд 9Коррозия - это вред
Коррозия металлов наносит большой экономический вред.
Человечество несет
Слайд 10Почему с коррозией нужно бороться?
Коррозия приводит ежегодно к миллиардным убыткам, и
Потери металла от коррозии составляют до 30% мирового производства.
Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Слайд 121. Полировка
Механическая полировка
металлов предполагает удаление микронеровностей и
Шлифовальный станок
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения.
Слайд 132. Покрытия
А) Неметаллические (лаки, краски)
Б) Химические (оксидирование,
В) Металлические
(Zn, Cu, Cr, Ni, Аu)
Вороненая
сталь
Хромирование
Цинкование
Золочение
Слайд 14Антикоррозионная «броня» современного автомобиля
должна состоять из слоев:
цинка,
грунта,
эмали,
лака.
Тесты, проводимые журналом
Слайд 15Применение цинкового покрытия в автомобильной промышленности
Существует два способа нанесения цинкового покрытия
В 1972 году фирма Porsche
представила экспериментальную
модель оцинкованного кузова со
сроком службы «более 20 лет». Но серийные кузова из оцинкованной стали появились намного позже — первым был седан Audi 80 образца 1986 года.
Слайд 163. Электрохимическая защита
А) Протекторная защита– к конструкции прикрепляют пластинку более активного
Этим методом защищают днища кораблей, трубы, кабели.
Слайд 17 Б) Катодная защита – поверхность
Этим методом защищают нефтепроводы, газопроводы.
Слайд 184. Использование нержавеющих сталей
Легирующие элементы Cr, Ni, Al,
5. Добавление ингибиторов – веществ, замедляющих коррозию
Ингибиторами кислотной коррозии являются преимущественно органические вещества (альдегиды, белки, серасодержащие органические вещества)
Ингибиторами в нейтральных средах являются фосфаты (Na3PO4), дихроматы(K2Cr2O7), сода (Na2CO3), силикаты (Na2SiO3), нитриты (NaNO2).
Слайд 19 Самостоятельная работа
1. Стальная водопроводная труба
а) почве; б) доме.
Расположите а, б по мере увеличения скорости коррозии металла трубы.
2. В какой стране и почему кузова машин (даже при условии одинаковой марки) корродируют быстрее:
а) Куба б) Египет в) Россия.
3. На огороде вы скрепили железную трубу с основой проволокой из а) алюминия; б) меди. В каком случае коррозия железной трубы будет быстрее?
4. Коррозия металлов под воздействием ингибиторов:
а) замедляется б) ускоряется в)протекает с неизменной скоростью
Слайд 20 Ответы
1. б, а
2. Куба, т.к. это островное государство, находящееся в
3. б – медь
4. а
Слайд 23Коррозия металлов
Подготовил: преподаватель химии ГБОУ СПО БМК
Емченко Юлия Геннадьевна
Белорецкий
г. Белорецк, Республика Башкортостан