Бузюрова О.В.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Конспект и презентация урока по химии 8 класс УМК О.С. Габриелян Основания, их классификация и химические свойства в свете ТЭД (1 часть)
Содержание
- 1. Конспект и презентация урока по химии 8 класс УМК О.С. Габриелян Основания, их классификация и химические свойства в свете ТЭД (1 часть)
- 2. Закончите молекулярные уравнения возможных реакций и запишите
- 3. а) ZnO + 2HNO3 = Zn(NO3)2 + H2O ZnO
- 4. Определение основанийМе(ОН)nКОН Ca(ОН)2 Al(ОН)3
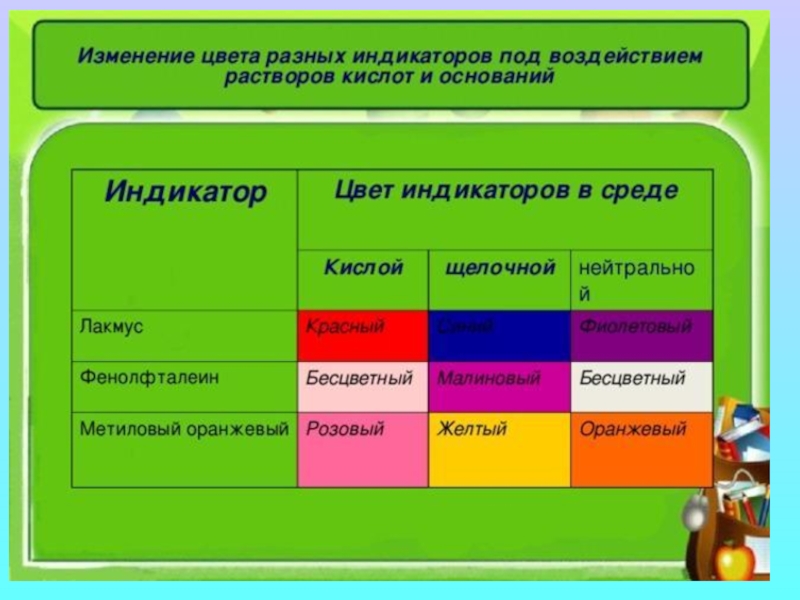
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Сильные и слабые основания
- 12. 1.В реакцию с раствором гидроксида калия вступает1)
- 13. Проверь себя:1.-3Для того чтобы реакция соли с
- 14. Домашнее задание: 1.Изучить §40 , 2.выполнить упражнение №1,33.Дополнительный материал: практическое применение гидроксидов.
Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения:а) ZnO + HNO3 → б) Al + H2SO4(разб) → в) HNO3 + CuSO4 → г) HCl + FeS → д) H2SO4 + Fe(OH)3 → Если
Слайд 1«Основания, их классификация и химические свойства в свете ТЭД»
(1 часть)
Химия
8
класс
Слайд 2Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения:
а)
ZnO + HNO3 →
б) Al + H2SO4(разб) →
в) HNO3 + CuSO4 →
г) HCl + FeS →
д) H2SO4 + Fe(OH)3 →
Если реакция не может быть осуществлена, объясните почему
Если реакция не может быть осуществлена, объясните почему
Слайд 3
а) ZnO + 2HNO3 = Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3− = Zn2+ + 2NO3− +
H2O
ZnO + 2H + = Zn 2+ + H2O
б) 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H3↑
2Al0 + 6H+ + 3SO42 − = 2Al3+ + 3SO42 − + 3H20↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
в) 2HNO3 + CuSO4 = Cu(NO3)2 + H2SO4
2H+ + 2NO3− + Cu2 −+ SO42− = Cu2 −+ 2NO3− + 2H+ + SO42−
Реакция не идет так как в результате: 1) не образуется вода, 2)не выделяется газ, и 3) не выпадает осадок.
г) 2HCl + FeS = FeCl2 + H2S↑
2H+ + 2Cl− + FeS = Fe2+ + 2Cl− + H2S↑
2H+ + FeS = H2↑
д) 3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42− + 2Fe(OH)3 = 2Fe3+ + 3SO42+ + 6H2O
6H+ + 2Fe(OH)3 = 2Fe3+ + 6H2O
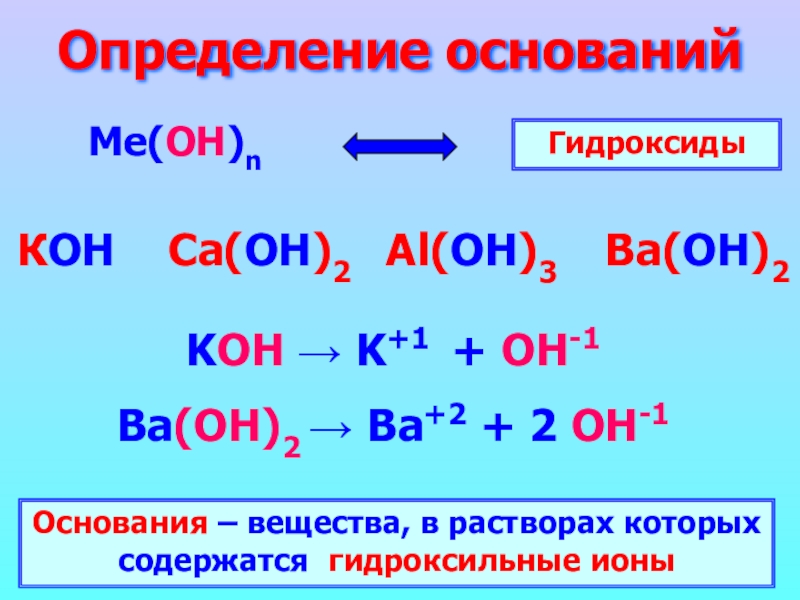
Слайд 4Определение оснований
Ме(ОН)n
КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2
Гидроксиды
KOH →
K+1 + OH-1
Ba(ОН)2 → Ba+2 + 2 OH-1
Ba(ОН)2 → Ba+2 + 2 OH-1
Основания – вещества, в растворах которых содержатся гидроксильные ионы
Слайд 12
1.В реакцию с раствором гидроксида калия вступает
1)
2)
3)
4)
2.Гидроксид
меди(II) реагирует с
1) оксидом бария
2) соляной кислотой
3) хлоридом калия
4) гидроксидом нат
3.Гидроксид железа(III) в отличие от гидроксида натрия
1) легко растворяется в
2) разлагается при небольшом нагревании
3) взаимодействует с фосфорной кислотой
4) реагирует с алюминием
1) оксидом бария
2) соляной кислотой
3) хлоридом калия
4) гидроксидом нат
3.Гидроксид железа(III) в отличие от гидроксида натрия
1) легко растворяется в
2) разлагается при небольшом нагревании
3) взаимодействует с фосфорной кислотой
4) реагирует с алюминием
Слайд 13Проверь себя:
1.-3
Для того чтобы реакция соли с гидроксидом калия проходила необратимо,
в качестве продукта должен выделяться осадок или газ. В случае реакции с нитратом железа (III) будет образовываться нерастворимый гидроксид железа (III).
2.-2
Гидроксиды (в том числе нерастворимые) реагируют с кислотами
3.-2
Эти гидроксиды будут реагировать с кислотами, а также с амфотерным алюминием. Однако при нагревании гидроксид железа(III) разлагается на оксид железа(III) и воду.
2.-2
Гидроксиды (в том числе нерастворимые) реагируют с кислотами
3.-2
Эти гидроксиды будут реагировать с кислотами, а также с амфотерным алюминием. Однако при нагревании гидроксид железа(III) разлагается на оксид железа(III) и воду.
Слайд 14Домашнее задание:
1.Изучить §40 ,
2.выполнить упражнение №1,3
3.Дополнительный материал: практическое применение
гидроксидов.