- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кислоты в свете ТЭД, их классификация и свойства
Содержание
- 1. Кислоты в свете ТЭД, их классификация и свойства
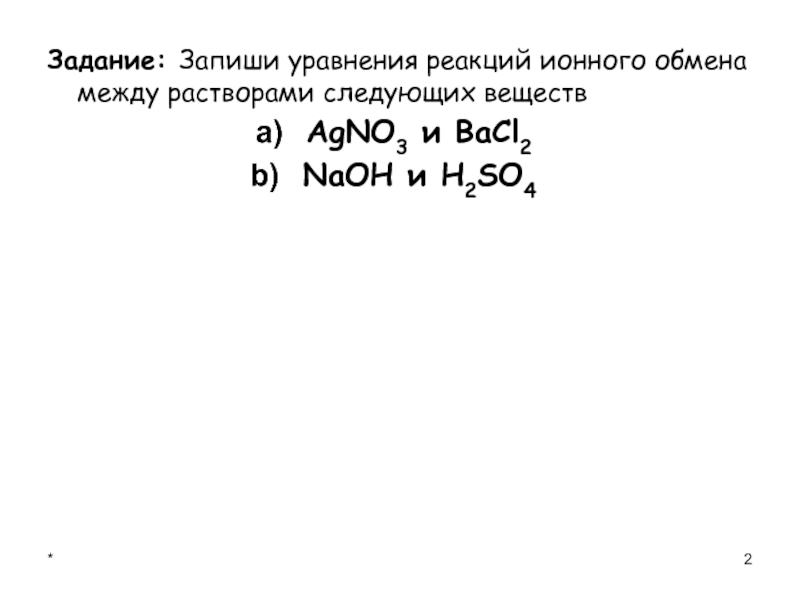
- 2. Задание: Запиши уравнения реакций ионного обмена между растворами следующих веществ AgNO3 и BaCl2 NaOH и H2SO4*
- 3. *Кислоты – это сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков.
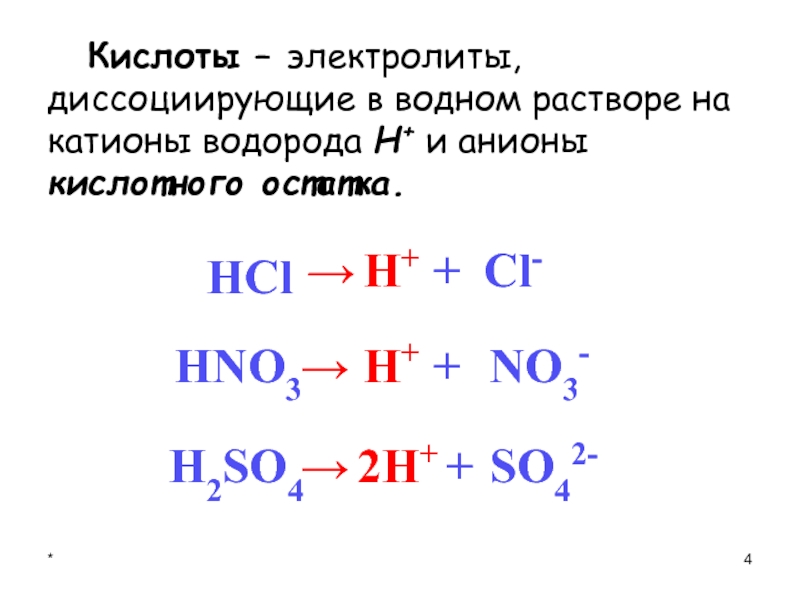
- 4. * Кислоты – электролиты, диссоциирующие в водном растворе на катионы водорода Н+ и анионы кислотного остатка.H2SO4→2H++H+H+→→HNO3HСl++Cl-SO42-NO3-
- 5. *Задание. Заполните в тетради таблицу
- 6. *
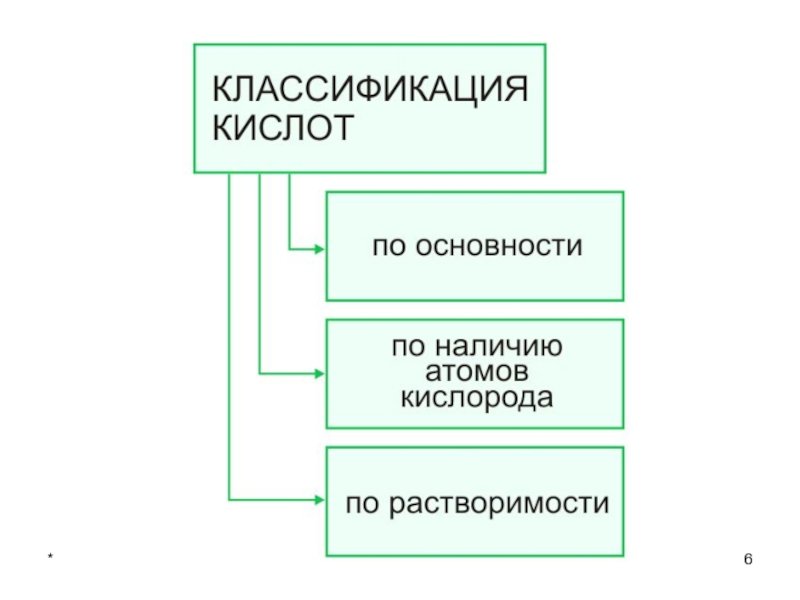
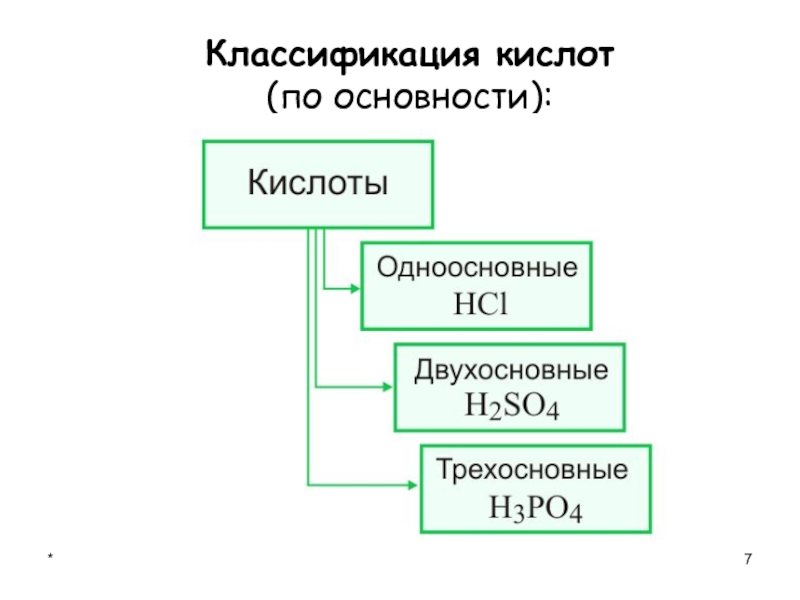
- 7. *Классификация кислот (по основности):
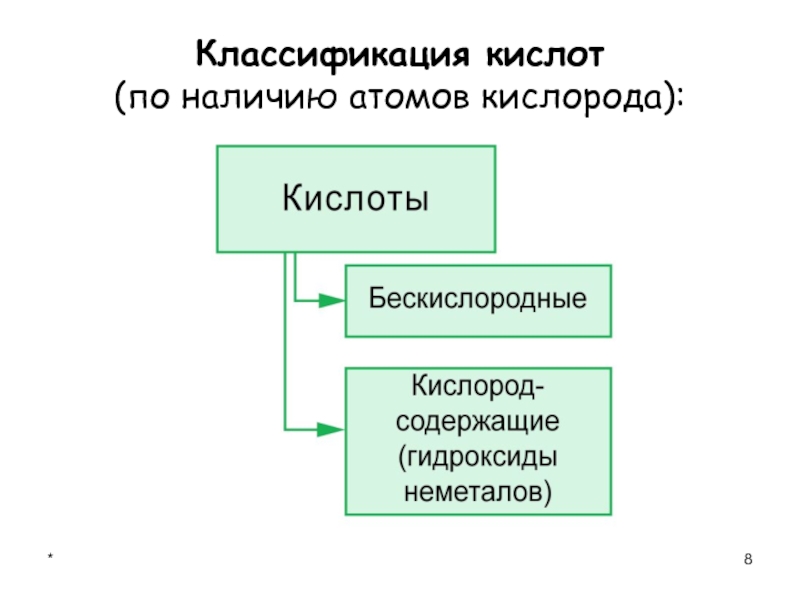
- 8. *Классификация кислот (по наличию атомов кислорода):
- 9. *Классификация кислотПо растворимости:РастворимыеНерастворимыеПо летучести:Летучие НелетучиеПо степени электролитической диссоциации:СильныеСлабые
- 10. *Классификация кислотПо стабильности Стабильные НестабильныеH2CO3 = CO2↑
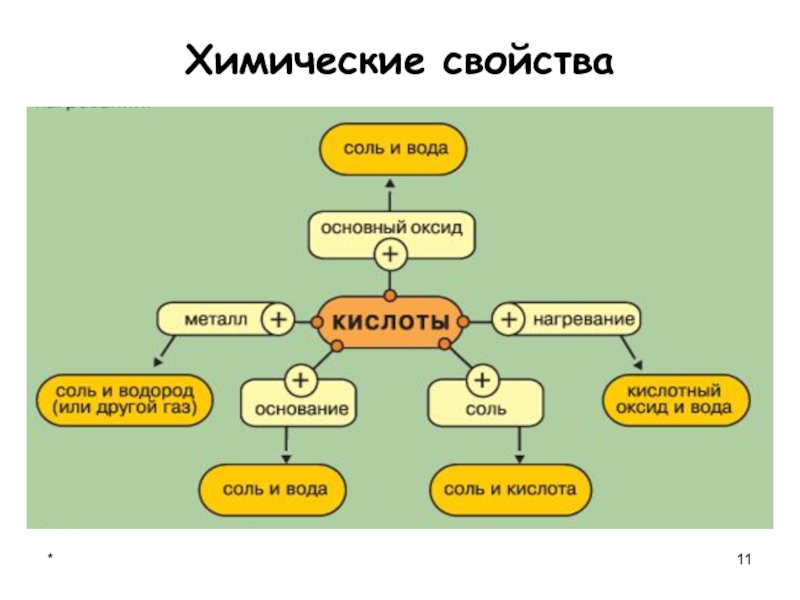
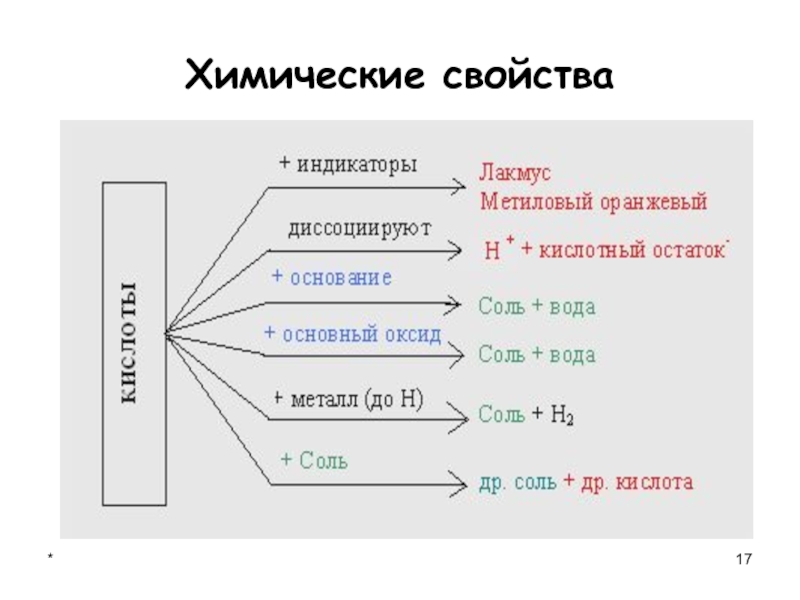
- 11. *Химические свойства
- 12. *Химические свойства (изменение окраски индикаторов)
- 13. *Химические свойстваИзменяют окраску индикаторов
- 14. *Правила работы с кислотамиПроявлять осторожность.При попадании на
- 15. *Химические свойстваКонцентрированные кислоты разрушают ткани, обугливают бумагу, сахар
- 16. *Обугливание сахарозы
- 17. *Химические свойства
- 18. *Задание. Напишите уравнения возможных реакций в молекулярном
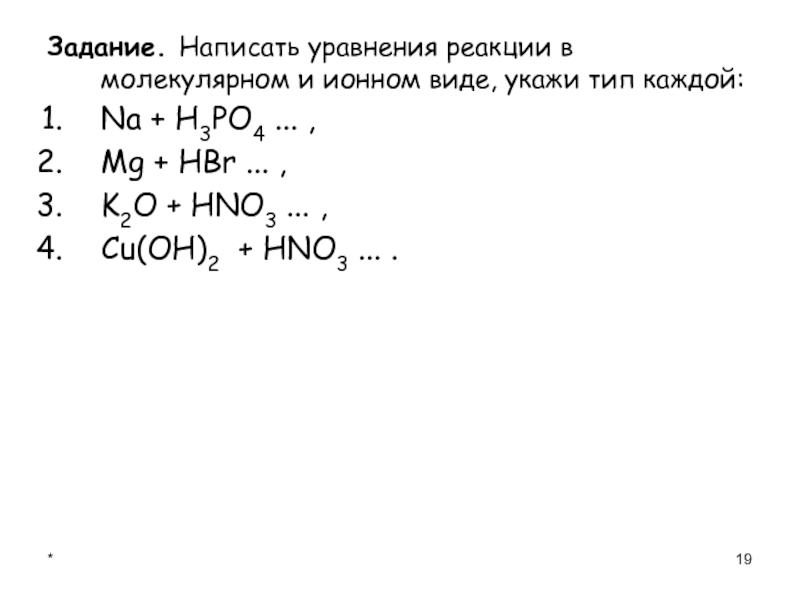
- 19. *Задание. Написать уравнения реакции в молекулярном и
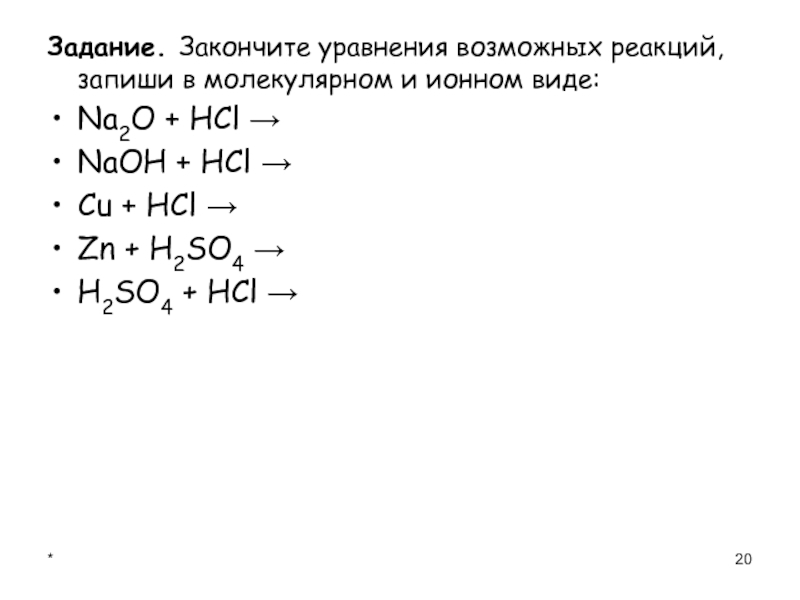
- 20. *Задание. Закончите уравнения возможных реакций, запиши в
- 21. *Задание. Составь возможные уравнения реакций взаимодействия перечисленных
- 22. *Задача. Рассчитай объём водорода (н.у.), который выделится
Задание: Запиши уравнения реакций ионного обмена между растворами следующих веществ AgNO3 и BaCl2 NaOH и H2SO4*
Слайд 2Задание: Запиши уравнения реакций ионного обмена между растворами следующих веществ
AgNO3
и BaCl2
NaOH и H2SO4
NaOH и H2SO4
*
Слайд 3*
Кислоты – это сложные вещества, молекулы которых состоят из ионов водорода
и кислотных остатков.
Слайд 4*
Кислоты – электролиты, диссоциирующие в водном растворе на катионы водорода Н+
и анионы кислотного остатка.
H2SO4
→
2H+
+
H+
H+
→
→
HNO3
HСl
+
+
Cl-
SO42-
NO3-
Слайд 9*
Классификация кислот
По растворимости:
Растворимые
Нерастворимые
По летучести:
Летучие
Нелетучие
По степени электролитической диссоциации:
Сильные
Слабые
Слайд 10*
Классификация кислот
По стабильности
Стабильные
Нестабильные
H2CO3 = CO2↑ +H2O – угольная кислота
H2SO3 = SO2↑+H2O – сернистая кислота
В свободном виде не существуют, распадаются на газ и воду.
В свободном виде не существуют, распадаются на газ и воду.
Слайд 14*
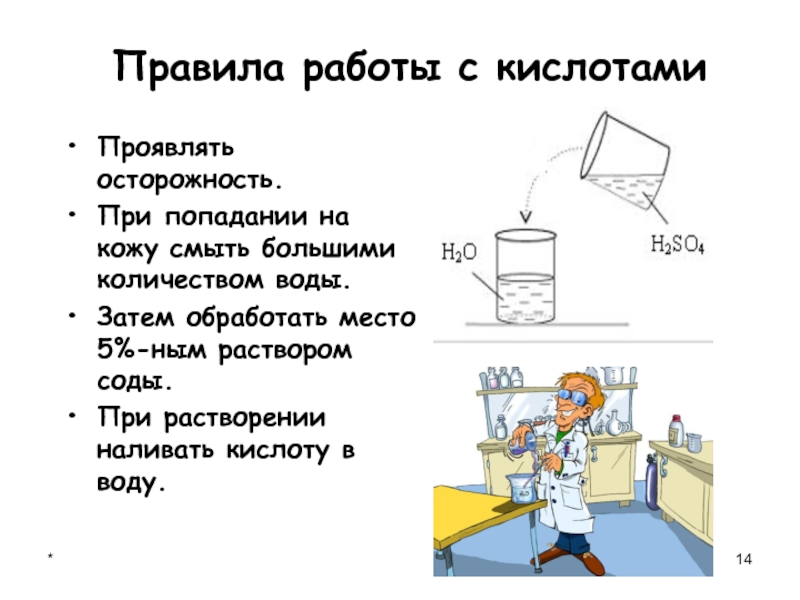
Правила работы с кислотами
Проявлять осторожность.
При попадании на кожу смыть большими количеством
воды.
Затем обработать место 5%-ным раствором соды.
При растворении наливать кислоту в воду.
Затем обработать место 5%-ным раствором соды.
При растворении наливать кислоту в воду.
Слайд 18*
Задание. Напишите уравнения возможных реакций в молекулярном и ионном виде.
HNO3 +
NaOH =
HCL + Cu(OH)2 =
MgO + H2SO4 =
Fe + HCL =
Pb + H2SO4 =
HNO3 + CaCO3 =
HCL + Cu(OH)2 =
MgO + H2SO4 =
Fe + HCL =
Pb + H2SO4 =
HNO3 + CaCO3 =
Слайд 19*
Задание. Написать уравнения реакции в молекулярном и ионном виде, укажи тип
каждой:
Na + Н3PO4 ... ,
Mg + НBr ... ,
K2O + НNO3 ... ,
Cu(OH)2 + НNO3 ... .
Na + Н3PO4 ... ,
Mg + НBr ... ,
K2O + НNO3 ... ,
Cu(OH)2 + НNO3 ... .
Слайд 20*
Задание. Закончите уравнения возможных реакций, запиши в молекулярном и ионном виде:
Na2O
+ HCl →
NaOH + HCl →
Cu + HCl →
Zn + H2SO4 →
H2SO4 + HCl →
NaOH + HCl →
Cu + HCl →
Zn + H2SO4 →
H2SO4 + HCl →
Слайд 21*
Задание. Составь возможные уравнения реакций взаимодействия перечисленных веществ с серной кислотой
в ионном виде:
Оксид кремния (ΙV)
Гидроксид лития
Нитрат бария
Соляная кислота
Оксид калия
Силикат калия
Нитрат натрия
Гидроксид железа (ΙΙ)
Оксид кремния (ΙV)
Гидроксид лития
Нитрат бария
Соляная кислота
Оксид калия
Силикат калия
Нитрат натрия
Гидроксид железа (ΙΙ)
Слайд 22*
Задача. Рассчитай объём водорода (н.у.), который выделится при растворении в соляной
кислоте 120 г магния, содержащего 2,5 % примесей.