- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему кислоты
Содержание
- 1. кислоты
- 2. Что такое кислотыЭто слово не новое для
- 3. Вопросы для разминкиЭта кислота применяется для лечения
- 4. Вопросы для разминкиГоложаберные моллюски в качестве самообороны
- 5. Вопросы для разминкиОбмен веществ у теплокровных животных
- 6. Вопросы для разминкиТропический паук педипальтида стреляет во
- 7. Вопросы для разминкиКосточки вишни и сливы необходимо
- 8. Вопросы для разминкиЭта кислота всегда содержится в
- 9. Вопросы для разминкиВ чистом виде эта кислота
- 10. Вопросы для разминкиКомпонент Кока-Колы, придающий этому напитку
- 11. Вопросы для разминкиЭта пищевая кислота получается из
- 12. Вопросы для разминкиЛекарственное вещество, применяется как обезболивающее и жаропонижающее средство..…другое его название «аспирин»ОТВЕТ: АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА
- 13. Что же такое кислота?Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
- 14. Формула кислотыВсе кислоты содержат водород, который в
- 15. Как составляют название бескислородной кислоты?К названию кислотообразующего
- 16. Как составляют название кислородосодержащей кислоты?К русскому названию
- 17. HNO3 - азотная кислотаHNO2 -
- 18. Степени окисленияПо формулам кислот можно определить степени
- 19. Степени окисленияПо формулам кислот можно определить степени
- 20. Определение оксидов соответствующих кислотеЗная степень окисления элемента-неметалла,
- 21. Определение оксидов соответствующих кислотеЗная степень окисления элемента-неметалла,
- 22. Определение заряда кислотного остатка (по формуле
- 23. Слайд 23
- 24. Кислоты также классифицируют по:содержанию кислородарастворимости происхождению агрегатному состоянию и т.д.
- 25. Слайд 25
- 26. Слайд 26
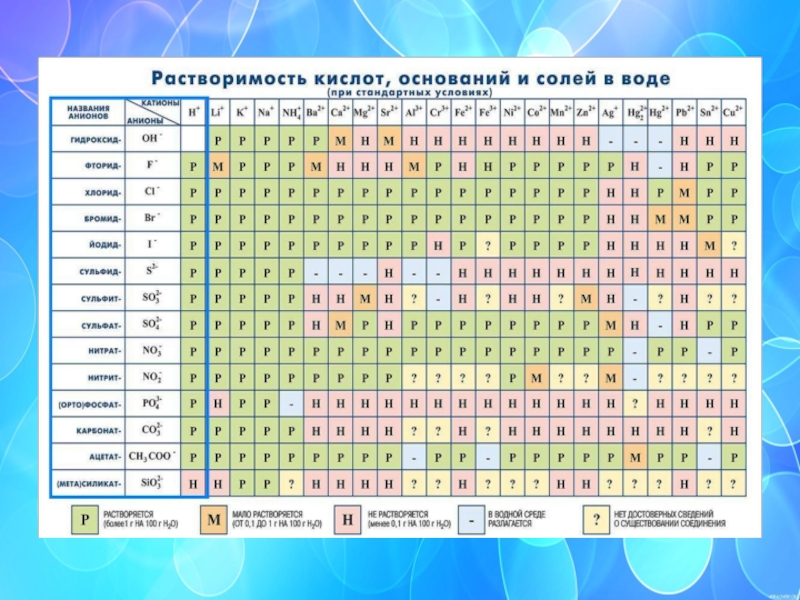
- 27. смотри Таблицу растворимости кислот, оснований и солей в воде
- 28. Слайд 28
- 29. Угольная и сернистая кислоты в свободном виде не существуют, так как распадаются на газ и воду
- 30. ПОДВЕДЕМ ИТОГ: План описания кислоты1. Формула2. Наличие
- 31. Многие кислоты, например, серная и соляная, нужны
- 32. Серная кислота H2SO4Бесцветная жидкость, вязкая как масло,
- 33. Серная кислота обугливает древесину, кожу, ткани. Если
- 34. Соляная кислота HClПри обычных условиях – это
- 35. Соляная кислота применяется в таких областях народного
- 36. Техника безопасности при работе с кислотамиВсе кислоты
- 37. Техника безопасности при работе с серной кислотойПри
- 38. Техника безопасности при работе с кислотамиПри работе
- 39. При попадании кислоты на кожу происходит химический
- 40. Определение кислотРастворы всех кислот кислые, но распознать
- 41. Изменение окраски индикаторов в кислотной средеКремниевую кислоту, поскольку она нерастворима в воде, так распознавать нельзя
- 42. Определение кислот с помощью универсального индикатораУниверсальный индикатор
- 43. Шкала рН («пэ-аш») и окраска универсального индикатора
- 44. Кислотность различных продуктов, бытовых веществ и растворов
- 45. ВыводыI Чтобы охарактеризовать кислоту, нужно придерживаться следующего
- 46. ИсточникиГабриелян, О.С. Химия 8 класс: учебник – М: Дрофа, 2018. – 287 с.: ил.https://www.0362.ua/news/895366/6-interesnyh-faktov-o-kislotahhttps://educontest.net/ru/1757826/%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%B5%D1%81%D0%BD%D0%BE%D0%B5-%D0%BF%D1%80%D0%BE-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B/https://megatopof.ru/prochee/kakaya-silnaya-opasnaya-kislota.html
Что такое кислотыЭто слово не новое для школьника. Каждый хоть раз принимал витамин С – аскорбиновую кислоту, пробовал кислые зеленые листочки щавеля, который обязан своим вкусом щавелевой кислоте, мама или бабушка консервируют овощи с помощью уксусной
Слайд 2Что такое кислоты
Это слово не новое для школьника. Каждый хоть раз
принимал витамин С – аскорбиновую кислоту, пробовал кислые зеленые листочки щавеля, который обязан своим вкусом щавелевой кислоте, мама или бабушка консервируют овощи с помощью уксусной кислоты, реклама рассказывает о «фруктовых кислотах» в косметике…Это лишь несколько примеров кислот, окружающих нас в быту, природе, лекарствах, пище и даже в нашем организме.
Слайд 3Вопросы для разминки
Эта кислота применяется для лечения ревматизма…
…содержится в крапиве, иголках
сосны, пчелином яде…
…для самообороны применяют муравьи
ОТВЕТ: МУРАВЬИНАЯ КИСЛОТА
…для самообороны применяют муравьи
ОТВЕТ: МУРАВЬИНАЯ КИСЛОТА
Слайд 4Вопросы для разминки
Голожаберные моллюски в качестве самообороны выстреливают парами…кислоты
Эту кислоту называют
«матерью всех кислот», «кровью химии», т.к. она применяется при производстве других кислот
Из нее состоит «Мертвое озеро» на острове Сицилия
Образуется при взаимодействии сернистого газа, выделяющегося при извержении вулканов с парами воды и его окислении на воздухе
ОТВЕТ : СЕРНАЯ КИСЛОТА
Из нее состоит «Мертвое озеро» на острове Сицилия
Образуется при взаимодействии сернистого газа, выделяющегося при извержении вулканов с парами воды и его окислении на воздухе
ОТВЕТ : СЕРНАЯ КИСЛОТА
Слайд 5Вопросы для разминки
Обмен веществ у теплокровных животных происходит с учетом выработки
небольшого количества этой кислоты и именно она привлекает комаров и других паразитов, которые питаются кровью.
Образуется при квашении капусты…
…при скисании виноградного сока или молока
ОТВЕТ: МОЛОЧНАЯ КИСЛОТА
Образуется при квашении капусты…
…при скисании виноградного сока или молока
ОТВЕТ: МОЛОЧНАЯ КИСЛОТА
Слайд 6Вопросы для разминки
Тропический паук педипальтида стреляет во врагов струйкой жидкости содержащей
84%....кислоты
Некоторые дикорастущие растения выделяют ее для подавления роста или гибели других растений.
Первая кислота с которой познакомился человек…
Человек впервые познакомился с этой кислотой при брожении вин…
Сейчас эта кислота есть на каждой кухне
ОТВЕТ: УКСУСНАЯ КИСЛОТА
Некоторые дикорастущие растения выделяют ее для подавления роста или гибели других растений.
Первая кислота с которой познакомился человек…
Человек впервые познакомился с этой кислотой при брожении вин…
Сейчас эта кислота есть на каждой кухне
ОТВЕТ: УКСУСНАЯ КИСЛОТА
Слайд 7Вопросы для разминки
Косточки вишни и сливы необходимо удалять перед употреблением или
консервированием, потому что в них образуется ядовитая …. кислота
ОТВЕТ: СИНИЛЬНАЯ КИСЛОТА
ОТВЕТ: СИНИЛЬНАЯ КИСЛОТА
Слайд 8Вопросы для разминки
Эта кислота всегда содержится в желудочном соке, убивает всех
болезнетворных микробов, а также паразитов. Среда в нашем желудке настолько агрессивна, что если поместить в него бритвенное лезвие, то оно полностью растворится через неделю.
Это один из компонентов «царской водки», сильнейшего яда, способного растворить благородные металлы (золото, платину)
ОТВЕТ : СОЛЯНАЯ КИСЛОТА
Это один из компонентов «царской водки», сильнейшего яда, способного растворить благородные металлы (золото, платину)
ОТВЕТ : СОЛЯНАЯ КИСЛОТА
Слайд 9Вопросы для разминки
В чистом виде эта кислота не существует, т.к. ее
молекулы неустойчивы.
Небольшое ее количество образуется при растворении углекислого газа в воде. Такой раствор называется «содовой водой»
ОТВЕТ: УГОЛЬНАЯ КИСЛОТА
Небольшое ее количество образуется при растворении углекислого газа в воде. Такой раствор называется «содовой водой»
ОТВЕТ: УГОЛЬНАЯ КИСЛОТА
Слайд 10Вопросы для разминки
Компонент Кока-Колы, придающий этому напитку кислотность рН 2.8. Благодаря
чему, опустив в стакан с напитком ювелирное украшение, можно избавиться от налета и загрязнений.
Применяется для защиты от коррозии трубопроводов, прокачивающих морскую воду
ОТВЕТ: ОРТОФОСФОРНАЯ КИСЛОТА
Применяется для защиты от коррозии трубопроводов, прокачивающих морскую воду
ОТВЕТ: ОРТОФОСФОРНАЯ КИСЛОТА
Слайд 11Вопросы для разминки
Эта пищевая кислота получается из плесневого гриба Aspergillus niger…
И
из лимонов (25 кг кислоты на тонну лимонов)
ОТВЕТ: ЛИМОННАЯ КИСЛОТА
ОТВЕТ: ЛИМОННАЯ КИСЛОТА
Слайд 12Вопросы для разминки
Лекарственное вещество, применяется как обезболивающее и жаропонижающее средство..
…другое его
название «аспирин»
ОТВЕТ: АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА
ОТВЕТ: АЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА
Слайд 13Что же такое кислота?
Кислотами называют сложные вещества, молекулы которых состоят из
атомов водорода и кислотного остатка.
Слайд 14Формула кислоты
Все кислоты содержат водород, который в формуле кислоты записывают на
первом месте:
HCl, H2SiO3
Остальная часть формулы называется кислотным остатком.
Как правило, кислотный остаток образуют атом элемента-неметалла или группа атомов (элемента-неметалла и кислорода):
HCl, H2SiO3
Валентность кислотного остатка равна числу атомов водорода в молекуле данной кислоты
HCl, H2SiO3
Остальная часть формулы называется кислотным остатком.
Как правило, кислотный остаток образуют атом элемента-неметалла или группа атомов (элемента-неметалла и кислорода):
HCl, H2SiO3
Валентность кислотного остатка равна числу атомов водорода в молекуле данной кислоты
Слайд 15Как составляют название бескислородной кислоты?
К названию кислотообразующего элемента добавляют гласную «о»
и слова «водородная кислота»
Пример:
HCl – хлороводородная кислота (соляная)
HF – фтороводородная кислота (плавиковая)
HBr – бромоводородная кислота
HI – йодоводородная кислота
H2S – сероводородная кислота
Пример:
HCl – хлороводородная кислота (соляная)
HF – фтороводородная кислота (плавиковая)
HBr – бромоводородная кислота
HI – йодоводородная кислота
H2S – сероводородная кислота
Слайд 16Как составляют название кислородосодержащей кислоты?
К русскому названию кислотообразующего элемента добавляют суффикс:
«ная»
- если элемент проявляет высшую степень окисления (равную номеру группы):
+6
H2SO4 серная кислота
- «истая» - если степень окисления ниже высшей
+4
H2SO3 сернистая кислота
+6
H2SO4 серная кислота
- «истая» - если степень окисления ниже высшей
+4
H2SO3 сернистая кислота
Слайд 17HNO3 - азотная кислота
HNO2 - азотистая кислота
H2SO4 -
серная кислота
H2SO3 - сернистая кислота
HClO4 - хлорная кислота
H2SiO3 - кремниевая кислота
H3PO4 - фосфорная кислота
H2SO3 - сернистая кислота
HClO4 - хлорная кислота
H2SiO3 - кремниевая кислота
H3PO4 - фосфорная кислота
Слайд 18Степени окисления
По формулам кислот можно определить степени окисления атомов химических элементов,
образующих кислоты.
Т.к. суммарная степень окисления атомов всех элементов равна нулю, у водорода степень окисления +1, а у кислорода -2, тогда обозначив за Х – степень окисления кислотообразующего элемента, составим уравнение
+1 х +1 -1
HCl, (+1)•1+х=0, х=-1, HCl
+1 х +1 -2
H2S, (+1)•2 +х=0, х=-2, H2S
+1х -1 +1+6-1
H2SO4 , (+1)•2 +х+(-2)•4=0, х=+6, H2SO4
Т.к. суммарная степень окисления атомов всех элементов равна нулю, у водорода степень окисления +1, а у кислорода -2, тогда обозначив за Х – степень окисления кислотообразующего элемента, составим уравнение
+1 х +1 -1
HCl, (+1)•1+х=0, х=-1, HCl
+1 х +1 -2
H2S, (+1)•2 +х=0, х=-2, H2S
+1х -1 +1+6-1
H2SO4 , (+1)•2 +х+(-2)•4=0, х=+6, H2SO4
Слайд 19Степени окисления
По формулам кислот можно определить степени окисления атомов химических элементов,
образующих кислоты.
Т.к. суммарная степень окисления атомов всех элементов равна нулю, у водорода степень окисления +1, а у кислорода -2, тогда обозначив за Х – степень окисления кислотообразующего элемента, составим уравнение
Т.к. суммарная степень окисления атомов всех элементов равна нулю, у водорода степень окисления +1, а у кислорода -2, тогда обозначив за Х – степень окисления кислотообразующего элемента, составим уравнение
Слайд 20Определение оксидов соответствующих кислоте
Зная степень окисления элемента-неметалла, образующего кислотный остаток кислородосодержащей
кислоты можно определить какой оксид ей соответствует.
Пример:
Для серной кислоты
+1 +6 -1
H2SO4
Степень окисления серы +6, соответствует оксид серы (VI)
+6
SO3
Пример:
Для серной кислоты
+1 +6 -1
H2SO4
Степень окисления серы +6, соответствует оксид серы (VI)
+6
SO3
Слайд 21Определение оксидов соответствующих кислоте
Зная степень окисления элемента-неметалла, образующего кислотный остаток кислородосодержащей
кислоты можно определить какой оксид ей соответствует.
Слайд 22Определение заряда кислотного остатка
(по формуле кислоты)
Заряд кислотного остатка всегда отрицателен
и равен числу атомов водорода в кислоте, которое называется основностью.
Кислотные остатки представляют собой ионы (простые S2- и сложные SO42-), которые образуются при растворении кислоты в воде.
Основность - это один из признаков, по которым классифицируют кислоты
Кислотные остатки представляют собой ионы (простые S2- и сложные SO42-), которые образуются при растворении кислоты в воде.
Основность - это один из признаков, по которым классифицируют кислоты
Слайд 24Кислоты также классифицируют по:
содержанию кислорода
растворимости
происхождению
агрегатному состоянию и т.д.
Слайд 29Угольная и сернистая кислоты в свободном виде не существуют, так как
распадаются на газ и воду
Слайд 30ПОДВЕДЕМ ИТОГ:
План описания кислоты
1. Формула
2. Наличие кислорода
3. Основность
4.Растворимость
5. Степени окисления элементов,
образующих кислоту
6. Заряд иона, образуемого кислотным остатком
7. Соответствующий оксид
6. Заряд иона, образуемого кислотным остатком
7. Соответствующий оксид
Слайд 31Многие кислоты, например, серная и соляная, нужны в народном хозяйстве в
огромных количествах. Познакомимся с ними подробнее
Слайд 32Серная кислота H2SO4
Бесцветная жидкость, вязкая как масло, не имеющая запаха, почти
вдвое тяжелее воды.
Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
Сильный окислитель, электролит
Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
Сильный окислитель, электролит
Слайд 33Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с серной
кислотой опустить лучину, то произойдет химическая реакция и лучина обуглится.
Теперь понятно, как опасно попадание брызг серной кислоты на кожу человека
Теперь понятно, как опасно попадание брызг серной кислоты на кожу человека
Слайд 34Соляная кислота HCl
При обычных условиях – это бесцветная жидкость с резким
запахом. Дымит на воздухе. Сильный электролит.
Содержится в желудочном соке человека
Содержится в желудочном соке человека
Слайд 35Соляная кислота применяется в таких областях народного хозяйства как:
гидрометаллургия и
гальванопластика, для травления, декапирования и лужения поверхности металлов;
пищевом производстве, как регулятор кислотности (добавка Е507);
в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
пищевом производстве, как регулятор кислотности (добавка Е507);
в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Слайд 36Техника безопасности при работе с кислотами
Все кислоты едкие, опасные вещества, требующие
осторожного обращения, так как способны вызывать тяжелые химические ожоги не только кожи, мягких и костных тканей при непосредственном контакте. Опасно также вдыхание паров кислот.
Наиболее распространенной является серная кислота, поэтому именно она считается наиболее опасной.
Наиболее распространенной является серная кислота, поэтому именно она считается наиболее опасной.
Слайд 37Техника безопасности при работе с серной кислотой
При смешивании серной кислоты с
водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего. Чтобы этого не случилось:
При растворении серной кислоты нужно вливать ее в воду тонкой струйкой и перемешивать
При растворении серной кислоты нужно вливать ее в воду тонкой струйкой и перемешивать
Слайд 38Техника безопасности при работе с кислотами
При работе с химическими растворами первым
делом, необходимо полностью защитить кожные покровы. На глазах должна присутствовать специальная маска или защитные очки. А при работе с кислотами обязательна защита органов дыхания с помощью респиратора или противогаза. Все работы должны производиться в специальном вытяжном шкафу.
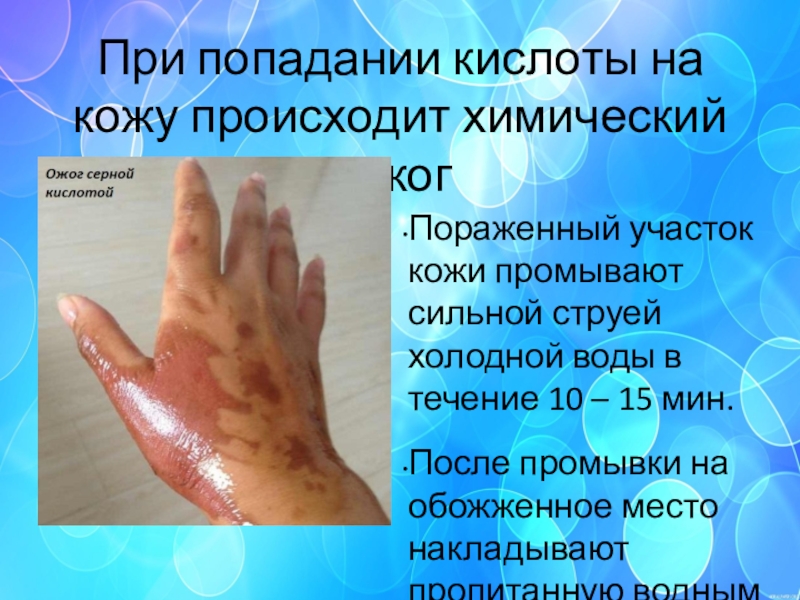
Слайд 39При попадании кислоты на кожу происходит химический ожог
Пораженный участок кожи промывают
сильной струей холодной воды в течение 10 – 15 мин.
После промывки на обожженное место накладывают пропитанную водным 2%-м раствором питьевой соды марлевую повязку или ватный тампон.
Через 10 мин. повязку снимают, кожу обмывают, осторожно удаляют влагу фильтровальной бумагой или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений
После промывки на обожженное место накладывают пропитанную водным 2%-м раствором питьевой соды марлевую повязку или ватный тампон.
Через 10 мин. повязку снимают, кожу обмывают, осторожно удаляют влагу фильтровальной бумагой или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений
Слайд 40Определение кислот
Растворы всех кислот кислые, но распознать концентрированные кислоты на вкус
не решится ни один химик – это опасно. Есть более эффективные и безопасные способы обнаружения кислот. Их так же, как щелочи, распознают с помощью индикаторов.
При добавлении к растворам кислот по нескольку капель индикаторов произойдет их окрашивание
При добавлении к растворам кислот по нескольку капель индикаторов произойдет их окрашивание
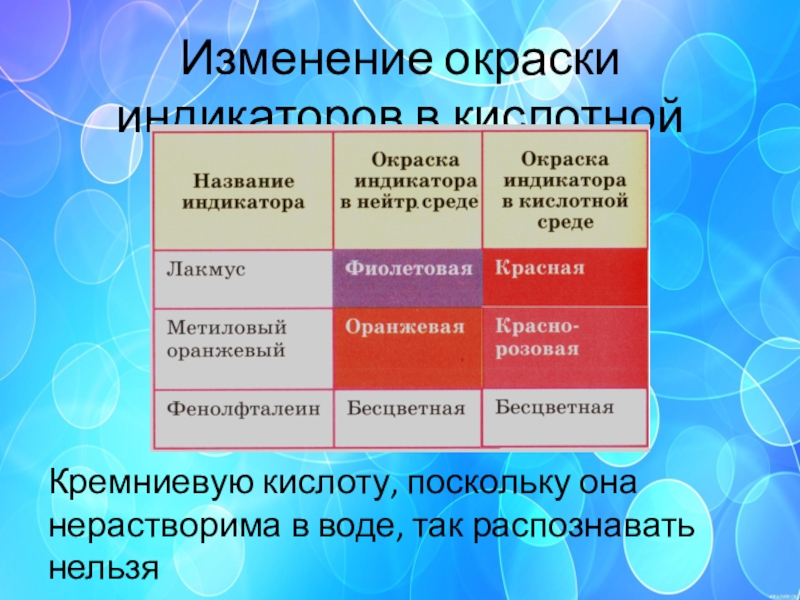
Слайд 41Изменение окраски индикаторов в кислотной среде
Кремниевую кислоту, поскольку она нерастворима в
воде, так распознавать нельзя
Слайд 42Определение кислот с помощью универсального индикатора
Универсальный индикатор представляет собой смесь индикаторов
, нанесенную на специальные бумажные полоски.
Изменение цвета при помещении такой полоски в испытуемый раствор сигнализирует не только о том, является ли среда раствора нейтральной, щелочной или кислотной, но также и том, насколько значительны его кислотность или щелочность, которые оцениваются путем сравнения со специальной шкалой, нанесенной на упаковку полосок .
Изменение цвета при помещении такой полоски в испытуемый раствор сигнализирует не только о том, является ли среда раствора нейтральной, щелочной или кислотной, но также и том, насколько значительны его кислотность или щелочность, которые оцениваются путем сравнения со специальной шкалой, нанесенной на упаковку полосок .
Слайд 43Шкала рН («пэ-аш») и окраска универсального индикатора в разных средах
Значение рН
нейтральной среды равно 7,0 (рН=7,0)
В кислотной среде значение рН меньше 7,0 (рН<7,0), и чем меньше эта величина, тем выше кислотность раствора.
В щелочной среде рН больше 7,0 (рН>7,0), и чем больше эта величина, тем выше щелочность раствора
В кислотной среде значение рН меньше 7,0 (рН<7,0), и чем меньше эта величина, тем выше кислотность раствора.
В щелочной среде рН больше 7,0 (рН>7,0), и чем больше эта величина, тем выше щелочность раствора
Слайд 44Кислотность различных продуктов, бытовых веществ и растворов кислот можно посмотреть перейдя по
ссылке
http://meandr.org/archives/24330
Для сравнения:
серная кислота рН=1,0
желудочный сок рН =1,0
лимонный сок рН=2,5
борная кислота, которой в медицине обрабатывают раны рН=5,2
шампунь рН=5,5
кожа здорового человека рН=6,5
Слайд 45Выводы
I Чтобы охарактеризовать кислоту, нужно придерживаться следующего алгоритма:
1. Формула
2. Наличие кислорода
3.
Основность
4.Растворимость
5. Степени окисления элементов, образующих кислоту
6. Заряд иона, образуемого кислотным остатком
7. Соответствующий оксид
8. рН
II Повреждающее действие на нашу кожу оказывают вещества рН которых отличается от рН нашей кожи, и чем значительнее отличие, тем опаснее повреждения, многие из которых (особенно вызванные действием концентрированных кислот) необратимы, вплоть до летального исхода. Поэтому при работе с кислотами обязательно нужно соблюдать технику безопасности.
4.Растворимость
5. Степени окисления элементов, образующих кислоту
6. Заряд иона, образуемого кислотным остатком
7. Соответствующий оксид
8. рН
II Повреждающее действие на нашу кожу оказывают вещества рН которых отличается от рН нашей кожи, и чем значительнее отличие, тем опаснее повреждения, многие из которых (особенно вызванные действием концентрированных кислот) необратимы, вплоть до летального исхода. Поэтому при работе с кислотами обязательно нужно соблюдать технику безопасности.
Слайд 46Источники
Габриелян, О.С. Химия 8 класс: учебник – М: Дрофа, 2018. –
287 с.: ил.
https://www.0362.ua/news/895366/6-interesnyh-faktov-o-kislotah
https://educontest.net/ru/1757826/%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%B5%D1%81%D0%BD%D0%BE%D0%B5-%D0%BF%D1%80%D0%BE-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B/
https://megatopof.ru/prochee/kakaya-silnaya-opasnaya-kislota.html
https://www.0362.ua/news/895366/6-interesnyh-faktov-o-kislotah
https://educontest.net/ru/1757826/%D0%B8%D0%BD%D1%82%D0%B5%D1%80%D0%B5%D1%81%D0%BD%D0%BE%D0%B5-%D0%BF%D1%80%D0%BE-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B/
https://megatopof.ru/prochee/kakaya-silnaya-opasnaya-kislota.html