- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кислород
Содержание
- 1. Кислород
- 2. Кислород 3История открытия 4Происхождение названия 9Расположение элементов 10Общая характеристика 12Состав воздуха 13Важность кислорода 14Получение кислорода 15Круговорот кислорода в природе 16 Тестовые задания 17ОГЛАВЛЕНИЕ
- 3. КИСЛОРОДКислоро́д — элемент 16-й группы (по устаревшей классификации — главной
- 4. о2о2ИСТОРИЯ ОТКРЫТИЯ КИСЛОРОДА
- 5. Вот история простая: Джозеф Пристли как-то раз, Окись ртути нагревая, Обнаружил странный газ.
- 6. Газ без цвета, без названья, Ярче
- 7. Новый газ из колбы вышел.Никому он не
- 8. Джозеф Пристли быстро пишет:Кошка греется на крыше,
- 9. ПРОИСХОЖДЕНИЕ НАЗВАНИЯСлово кислород (именовался в начале XIX века ещё
- 10. Кислород занимает 1
- 11. В земной коре – 49 %(атмосфера, литосфера,
- 12. Химический знак – О
- 13. В 1774 г. А. Лавуазье доказал,
- 14. Слайд 14
- 15. ПОЛУЧЕНИЕ КИСЛОРОДАВ настоящее время в промышленности кислород
- 16. Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
- 17. Кислород можно получить каталитическим разложением хлората калия
- 18. Кислород расходуется в природе на процессы окисления
- 19. ВОПРОС-ОТВЕТНазовите восьмой элемент «Периодической системы химических элементов
- 20. Всем спасибо за внимание!
Слайд 1Кислород
учитель химии высшей квалификационной категории
Гук Светлана Михайловна,
МБОУ «Средняя общеобразовательная
Слайд 2Кислород 3
История открытия 4
Происхождение названия 9
Расположение элементов 10
Общая характеристика 12
Состав воздуха 13
Важность кислорода 14
Получение кислорода 15
Круговорот кислорода
Тестовые задания 17
ОГЛАВЛЕНИЕ
Слайд 3КИСЛОРОД
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго
самым лёгким элементом из группы халькогенов. Простое вещество кислород при
нормальных условиях — газ без цвета и вкуса, молекула которого
состоит из двух атомов
кислорода (формула O2), в связи с чем его также называют дикислород
Слайд 5Вот история простая:
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил
Слайд 6 Газ без цвета, без названья,
Ярче в нем горит свеча.
А не вреден для дыханья?
Не узнаешь от врача.
Слайд 7Новый газ из колбы вышел.
Никому он не знаком.
Этим газом дышат
Под стеклянным колпаком,
Человек им тоже дышит...
Слайд 8Джозеф Пристли быстро пишет:
Кошка греется на крыше,
Солнца луч в окошко
Джозеф Пристли, с ним две мыши,
Открывает кислород.
Слайд 9ПРОИСХОЖДЕНИЕ НАЗВАНИЯ
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в
Ломоносов Михаил Васильевич (1711 - 1765)
Лавуазье Антуан Лоран
(1743-1994)
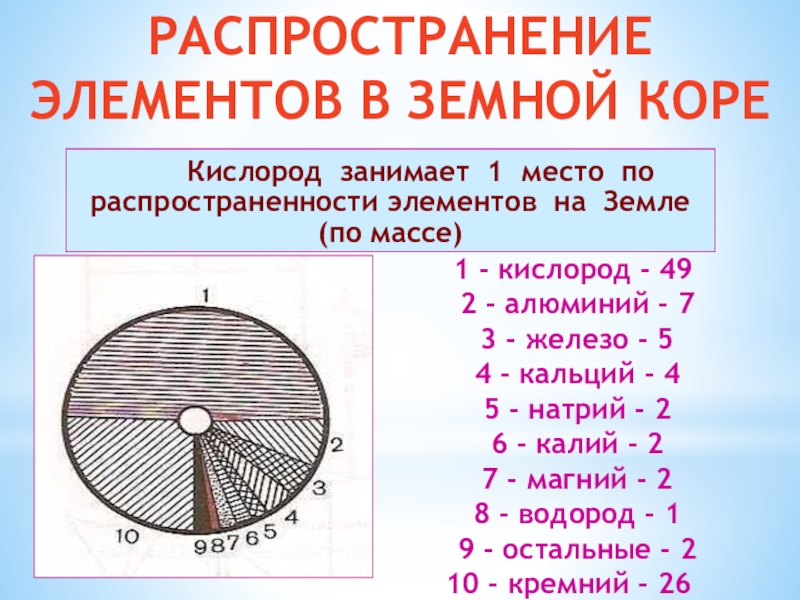
Слайд 10 Кислород занимает 1 место по распространенности элементов
РАСПРОСТРАНЕНИЕ ЭЛЕМЕНТОВ В ЗЕМНОЙ КОРЕ
1 - кислород - 49
2 - алюминий - 7
3 - железо - 5
4 - кальций - 4
5 - натрий - 2
6 - калий - 2
7 - магний - 2
8 - водород - 1
9 - остальные - 2
10 - кремний - 26
Слайд 11В земной коре – 49 %
(атмосфера, литосфера, гидросфера)
В воздухе –
В воде (в чистой воде – 88,8 %, в морской воде – 85,8 % )
В песке , многих
горных породах
и минералах
В составе органи-
ческих соединений:
белков, жиров,
углеводов и др.
В организме
человека – 62 %
РАСПОЛОЖЕНИЕ КИСЛОРОДА В ПРИРОДЕ
Слайд 12
Химический знак – О
Относительная атомная масса: Ar = 16
Изотопы кислорода – ( 99,75 %), ,
Строение атома: ( 8p+ + 8n0 ) + 8
Заряд ядра: ( +8)
Электронная конфигурация атома: 1s22s2 2p4
Типичный неметалл. Сильный окислитель ( по электроотрицательности уступает лишь фтору )
Валентные возможности: в соединениях обычно 2-х валентен, реже – 3-х, (4-х) валентен
Возможные степени окисления: - 2 , - 1 , 0 , + 2, (+4)
(наиболее характерные степени окисления: 0, - 2)
ОБЩАЯ ХАРАКТЕРИСТИКА КИСЛОРОДА
Слайд 13 В 1774 г. А. Лавуазье доказал, что воздух – это
СОСТАВ ВОЗДУХА
Слайд 15ПОЛУЧЕНИЕ КИСЛОРОДА
В настоящее время в промышленности кислород получают из воздуха.
В
На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Слайд 16Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида
Слайд 17Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
К лабораторным
Слайд 18
Кислород расходуется в природе на процессы окисления
(дыхания,
Масса кислорода в воздухе пополняется в ходе процесса фотосинтеза
свет
6СО2 + 6 Н2О = С6Н12О6 +6О2 ↑
КРУГОВОРОТ КИСЛОРОДА В ПРИРОДЕ
Слайд 19ВОПРОС-ОТВЕТ
Назовите восьмой элемент «Периодической системы химических элементов Д.И.Менделеева»
Кем и когда
Почему элемент № 8 был назван кислородом?
Где кислород встречается в природе?
Перечислите известные вам загрязнители воздуха
Дайте характеристику кислороду как химическому элементу
На каких физических свойствах кислорода основаны способы собирания его? Как можно обнаружить кислород?
Какие условия способствуют возникновению и прекращению горения?