- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кальций
Содержание
- 1. Кальций
- 2. Что же такое кальций? Ка́льций — элемент главной подгруппы второй
- 3. Слайд 3
- 4. История и происхождение названияНазвание элемента происходит от лат. calx (в
- 5. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути
- 6. Из шести природных изотопов кальция пять стабильны.
- 7. В горных породах и минералах
- 8. В биосфере
- 9. ПолучениеСвободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %)
- 10. Свойства
- 11. Физические свойства
- 12. Химические свойстваКальций — типичный щёлочноземельный металл. Химическая активность кальция
- 13. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций
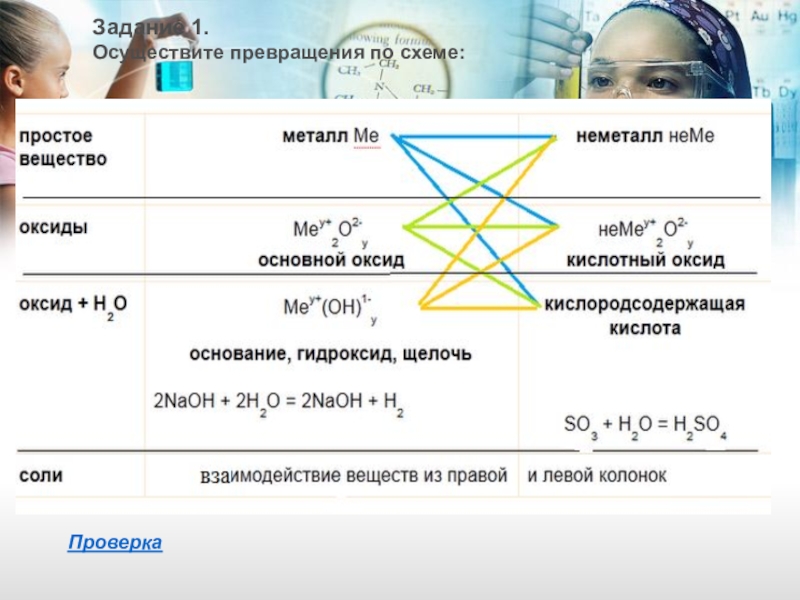
- 14. Задание 1.Осуществите превращения по схеме:Проверка
- 15. 1. Идем по синим стрелочкам - взаимодействие
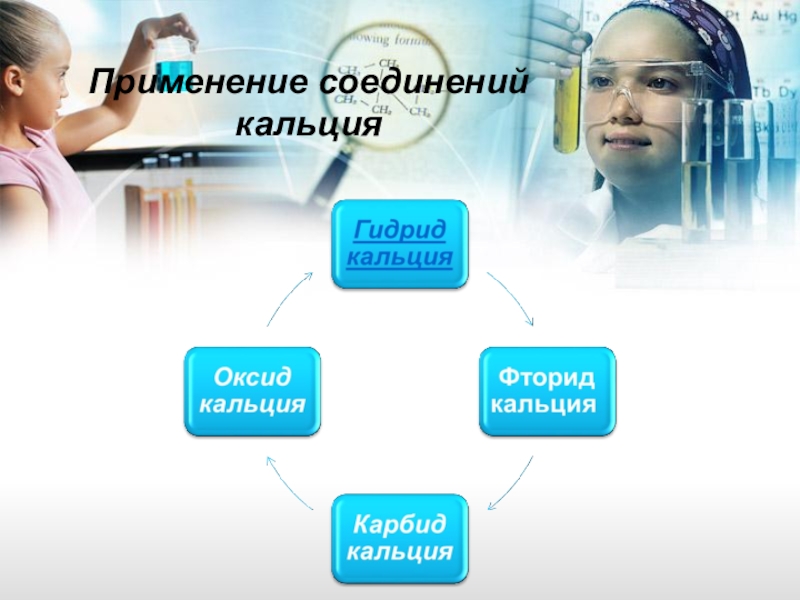
- 16. Применение соединений кальция
- 17. 1. Нагреванием кальция в атмосфере водорода получают CaH2 (гидрид кальция),
- 18. Слайд 18
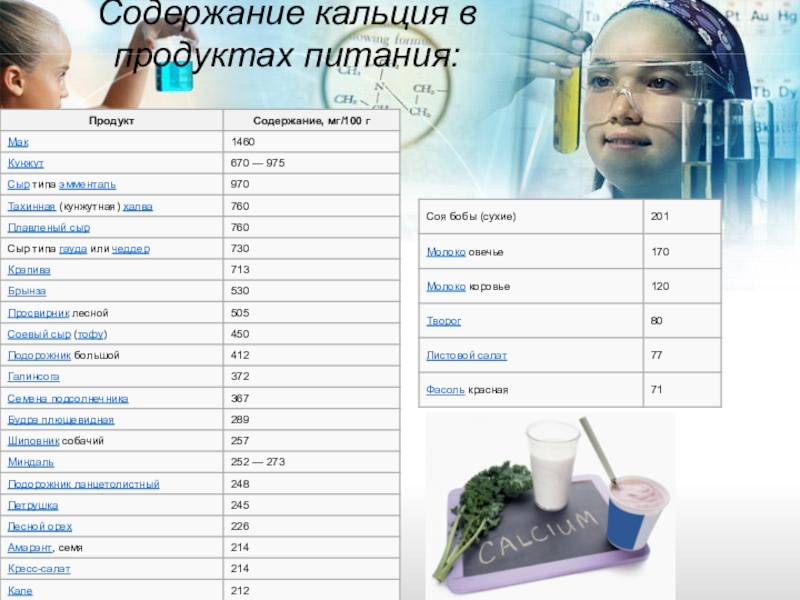
- 19. Содержание кальция в продуктах питания:
- 20. 1. Расскажите о биологической роли элементов магния
- 21. Слайд 21
- 22. ЛитератураО.С. Габриелян «Химия», Дрофа, 2010Л.А Слета: Справочник-Харьков:
Слайд 2Что же такое кальций?
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических
Слайд 4История и происхождение названия
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь»,
Оно было предложено английским химиком Хэмфри Дэви, в 1808 г.выделившим металлический кальций электролитическим методом.
Хэмфри Дэви
Слайд 5Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила
Установка для электролиза Х. Дэви
Слайд 6Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжелый
Нахождение в природе
Слайд 9Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из
Слайд 12Химические свойства
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем
Кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, бромом) кальций реагирует при обычных условиях:
Слайд 13С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при
Большинство из соединений кальция с неметаллами легко разлагается водой, например:
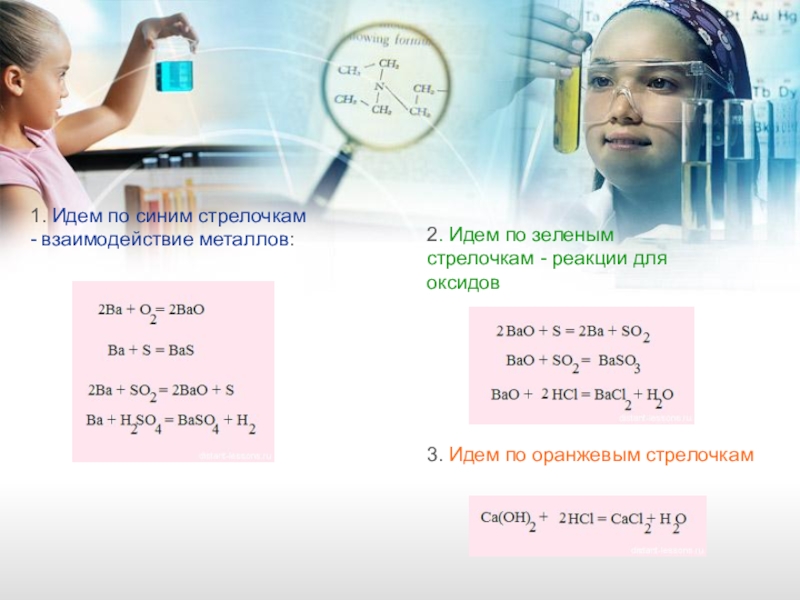
Слайд 151. Идем по синим стрелочкам - взаимодействие металлов:
2. Идем по зеленым
3. Идем по оранжевым стрелочкам
Слайд 171. Нагреванием кальция в атмосфере водорода получают CaH2 (гидрид кальция), используемый в металлургии (металлотермии)
2. Оксид металлов — бария и стронция (BaO, SrO), используется в качестве активного слоя катодов косвенного накала в вакуумных электронных приборах
3. Фторид кальция (флюорит) применяется в виде монокристаллов в оптике (астрономические объективы, линзы, призмы) и как лазерный материал. Вольфрамат кальция (шеелит) в виде монокристаллов применяется в лазерной технике, а также касцинтиллятор.
4. Карбид кальция CaC2 широко применяется для получения ацетилена и для восстановления металлов, а также при получении цианамида кальция (нагреванием карбида кальция в азоте при 1200 °C, реакция идет экзотермически, проводится в цианамидных печах).
Слайд 201. Расскажите о биологической роли элементов магния и кальция в живой
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca —> Ca(OH) 2—> CaCO3—> CaO —> Ca(OH) 2 —> CaCl2 —> Ca.
Уравнение последней реакции запишите также в ионной форме.
Закрепление
Слайд 22Литература
О.С. Габриелян «Химия», Дрофа, 2010
Л.А Слета: Справочник-Харьков: Фолио, 2005г
Э.В. Гурский: Пособие
Ресурсы Интернет
http://school-collection.edu.ru/
http://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D0%B9
http://dic.academic.ru/dic.nsf/es/24039/%D0%BA%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D0%B9
http://distant-lessons.ru/ximiya/shelochnozemelnye-metally
httphttp://http://ruhttp://ru.http://ru.vlabhttp://ru.vlab.http://ru.vlab.wikiahttp://ru.vlab.wikia.http://ru.vlab.wikia.comhttp://ru.vlab.wikia.com/http://ru.vlab.wikia.com/wikihttp://ru.vlab.wikia.com/wiki/