неорганической химии. Техника безопасности при работе в кабинете химии».
Составитель-Травкина Л.Ю., учитель химии высшей категории
МБОУ СОШ №186
г. Новосибирск
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Качественные реакции в неорганической химии. Техника безопасности при работе в кабинете химии.
Содержание
- 1. Качественные реакции в неорганической химии. Техника безопасности при работе в кабинете химии.
- 2. Тур № 1
- 3. Первый вопросСульфит натрия в
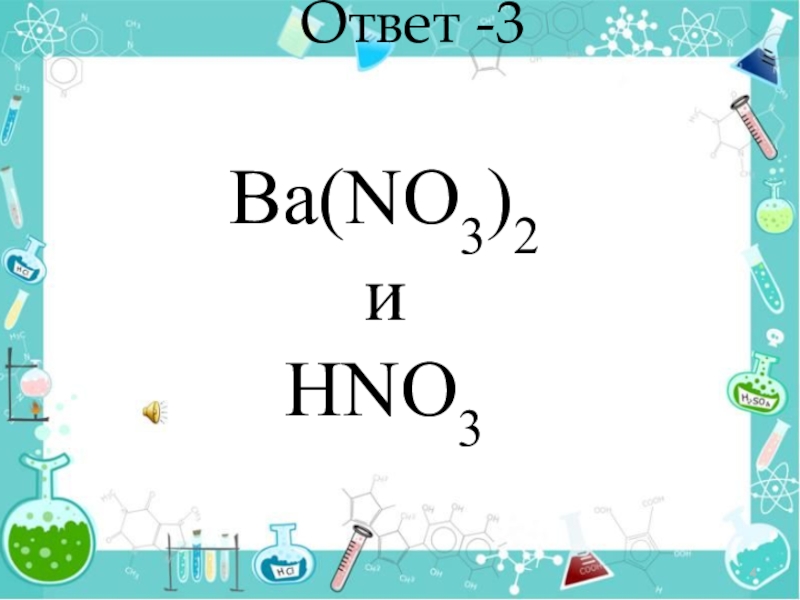
- 4. Ответ -3 Ba(NO3)2 и HNO3
- 5. Второй вопросОсадок образуется при взаимодействии водных растворов
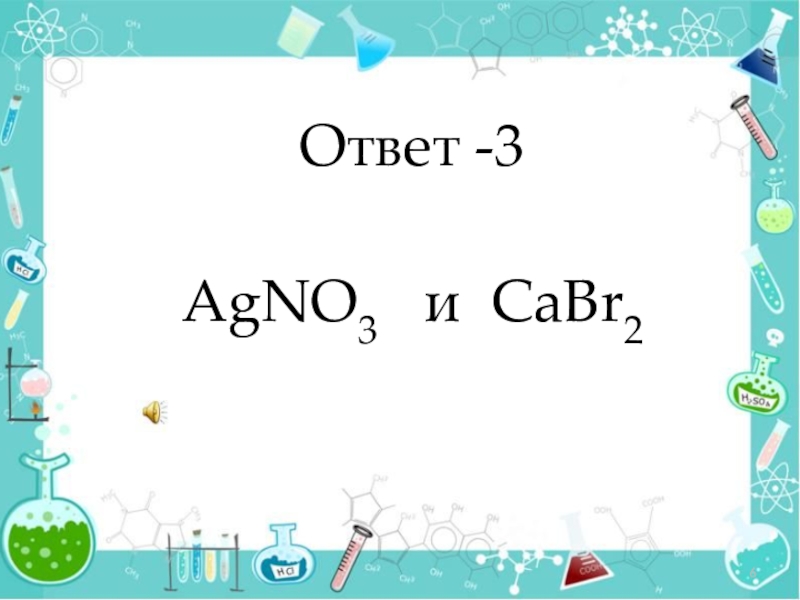
- 6. Ответ -3 AgNO3 и CaBr2
- 7. Третий вопросНеобратимое протекание реакции ионного обмена между растворами гидроксида бария и карбоната калия обусловлено взаимодействием ионов
- 8. Ответ -3 Ba2+ и CO32-
- 9. Четвертый вопросСокращённое ионное уравнение соответствует взаимодействию
- 10. Ответ-3 Fe CI3 и Ba(OH)2
- 11. Пятый вопросВ водном растворе
- 12. Ответ-3
- 13. Шестой вопрос Верны ли следующие суждения о
- 14. Ответ-4 В лаборатории лучше всегда носить
- 15. Седьмой вопросВерны ли следующие суждения о правилах
- 16. Ответ-4 В лаборатории можно
- 17. Восьмой вопрос Верны ли
- 18. Ответ-4 При
- 19. Тур № 2 Задача АУчащимся дали
- 20. Задача А ответ:Хризопраз - ионы
- 21. Тур № 2 Задача
- 22. Задача Б ответ:BaCl2 + Na2SO4
- 23. Тур № 3Для проведения опытов
- 24. Тур № 3ОтветОпределён состав вещества: CuCO3 —
- 25. Тур № 3При определении качественного
- 26. Тур № 3Ответ
- 27. Тур № 4К раствору сульфата
- 28. Тур № 4Ответ 1)
- 29. Тур № 5, определяющий
- 30. Тур № 5 ОтветКарбонат
- 31. Использованные материалы:https://chem-oge.sdamgia.ruhttps://paintingart.ru/articles/technologypainting/paint.htmlhttp://www.ug.ru/download/2009/fp0902_01.pdfhttps://studref.com/478560/kulturologiya/barievyy_kron_zheltyy_ultramarinhttps://www.afaya.ru/texnologicheskaya-informacziya/lerning/blanfiks.htmlhttps://chemicalbrosers.livejournal.com/14446.html
Тур № 1
Слайд 3 Первый вопрос
Сульфит натрия в водном растворе может вступать
в реакцию с каждым из веществ:
Ca( OH)2 и KOH
KNO3 и AgNO3
Ba(NO3)2 и HNO3
H2SO4 и (NH4)2CO3
Ca( OH)2 и KOH
KNO3 и AgNO3
Ba(NO3)2 и HNO3
H2SO4 и (NH4)2CO3
Слайд 7Третий вопрос
Необратимое протекание реакции ионного обмена между растворами гидроксида бария и
карбоната калия обусловлено взаимодействием ионов
Слайд 13Шестой вопрос
Верны ли следующие суждения о правилах безопасной работы в
лаборатории?
А. При получении кислорода из раствора пероксида водорода необходимо использовать резиновые перчатки.
Б. При растворении соды в воде необходимо надеть защитные очки.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А. При получении кислорода из раствора пероксида водорода необходимо использовать резиновые перчатки.
Б. При растворении соды в воде необходимо надеть защитные очки.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 14Ответ-4
В лаборатории лучше всегда носить очки и резиновые перчатки, однако при
обращении с неядовитыми и не едкими веществами (например, 3% раствор перекиси водорода используется в качестве дезинфицирующего средства в домашней аптечке) жесткой необходимости в использовании перчаток и очков нет.
Слайд 15Седьмой вопрос
Верны ли следующие суждения о правилах безопасной работы в химической
лаборатории?
А. В лаборатории нельзя знакомиться с запахом веществ.
Б. Серную кислоту следует растворять в горячей воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А. В лаборатории нельзя знакомиться с запахом веществ.
Б. Серную кислоту следует растворять в горячей воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 16Ответ-4
В лаборатории можно осторожно знакомиться с запахом веществ.
Серную кислоту следует
растворять только в холодной воде.
Слайд 17Восьмой вопрос
Верны ли следующие суждения об обращении
с растворами щелочей?
А. При попадании раствора щелочи на кожу рук его надо смыть водой.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А. При попадании раствора щелочи на кожу рук его надо смыть водой.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 18Ответ-4
При попадании раствора щелочи на кожу рук
его надо быстро смыть холодной водой, затем 2%раствором уксусной кислоты, и затем опять холодной водой. Таким образом, смывать только водой (а тем более раствором соды) неверно.
Слайд 19
Тур № 2
Задача А
Учащимся дали рассмотреть коллекцию минералов, содержащую четыре
образца: хризопраз (зеленый), цитрин (желтый), азурит (синий), гематит (красный) и, сравнивая их окраску с растворами уже известных солей, учащиеся сделали предположения о ионном составе минералов.
Слайд 20
Задача А ответ:
Хризопраз - ионы Ni2+ или Cu2+ (по сходству
с окраской соответствующих солей).
Цитрин - ионы Fe3+ (по сходству с окраской FeCl3).
Азурит - ионы Cu2+ (по сходству с окраской растворов солей меди). Гематит - ионы Fe3+ (Fe2O3).
Цитрин - ионы Fe3+ (по сходству с окраской FeCl3).
Азурит - ионы Cu2+ (по сходству с окраской растворов солей меди). Гематит - ионы Fe3+ (Fe2O3).
Слайд 21
Тур № 2 Задача Б
Искусство живописи построено на
красках. Именно благодаря им художник получает в свои руки мощное выразительное средство - цвет. Краски же - это не что иное, как образцы окрашенных веществ, растертые в связующем. Минеральные краски изготавливаются из природных и синтетических соединений. Давайте освоим древнюю технологию изготовления минеральных красок.
Получите три краски : белую (она называется баритовые белила), желтую (желтый ультрамарин) и красную (красный крон). В их основе лежат три соединения: сульфат бария, хромат бария и хромат свинца (II). Напишите формулы этих соединений.
У вас имеются следующие реактивы, взаимодействием которых эти вещества могут быть получены: BaCl2 , Na2SO4, K2CrO4 , Pb(CH3COO)2.
Напишите уравнения реакций ионного обмена между этими соединениями в молекулярной и ионной форме и объясните, почему они идут до конца.
Получите три краски : белую (она называется баритовые белила), желтую (желтый ультрамарин) и красную (красный крон). В их основе лежат три соединения: сульфат бария, хромат бария и хромат свинца (II). Напишите формулы этих соединений.
У вас имеются следующие реактивы, взаимодействием которых эти вещества могут быть получены: BaCl2 , Na2SO4, K2CrO4 , Pb(CH3COO)2.
Напишите уравнения реакций ионного обмена между этими соединениями в молекулярной и ионной форме и объясните, почему они идут до конца.
Слайд 22
Задача Б ответ:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
(бланфикс)
BaCl2 + K2CrO4 = 2KCl + BaCrO4
Крон баритовый ,желтый ультрамарин, хромат бария.
Pb(CH3COO)2 + K2CrO4 = 2CH3COOK + PbCrO4
Крон свинцовый красный, крокоит, хромат свинца(II)
BaCl2 + K2CrO4 = 2KCl + BaCrO4
Крон баритовый ,желтый ультрамарин, хромат бария.
Pb(CH3COO)2 + K2CrO4 = 2CH3COOK + PbCrO4
Крон свинцовый красный, крокоит, хромат свинца(II)
Слайд 23
Тур № 3
Для проведения опытов по изучению свойств соли был
выдан белый, нерастворимый в воде порошок с зеленоватым оттенком.
Для определения его качественного состава выданную соль подвергли термическому разложению, в результате которого образовалось два оксида. Один из них — порошок чёрного цвета, при добавлении к которому раствора серной кислоты и последующем нагревании образовался раствор голубого цвета. Про другой известно, что это газ тяжёлее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
Запишите химическую формулу и название выданного вещества. Составьте два уравнения реакций, которые были проведены в процессе исследования его свойств.
Для определения его качественного состава выданную соль подвергли термическому разложению, в результате которого образовалось два оксида. Один из них — порошок чёрного цвета, при добавлении к которому раствора серной кислоты и последующем нагревании образовался раствор голубого цвета. Про другой известно, что это газ тяжёлее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
Запишите химическую формулу и название выданного вещества. Составьте два уравнения реакций, которые были проведены в процессе исследования его свойств.
Слайд 24
Тур № 3
Ответ
Определён состав вещества: CuCO3 — карбонат меди(II).
Составлены два уравнения реакции:
1)CuCO3
= CuO + CO2
2) CuO + H2SO4 = CuSO4 + H2O
2) CuO + H2SO4 = CuSO4 + H2O
Слайд 25
Тур № 3
При определении качественного состава неизвестного кристаллического вещества белого
цвета было установлено, что его раствор взаимодействует с раствором гидроксида калия с образованием осадка. А при добавлении к раствору исследуемого вещества раствора нитрата бария выпадает осадок белого цвета, не растворимый в кислотах.
Известно, что катион металла, входящий в состав данного соединения, входит в состав хлорофилла. Этот металл ранее применялся также в фотографии для получения вспышки.
Определите состав и запишите название исходного вещества. Запишите два уравнения реакций, которые были проведены в процессе определения качественного состава неизвестного вещества/
Известно, что катион металла, входящий в состав данного соединения, входит в состав хлорофилла. Этот металл ранее применялся также в фотографии для получения вспышки.
Определите состав и запишите название исходного вещества. Запишите два уравнения реакций, которые были проведены в процессе определения качественного состава неизвестного вещества/
Слайд 27
Тур № 4
К раствору сульфата алюминия массой 68,4 г и
массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
Слайд 28
Тур № 4
Ответ
1) Составим уравнение реакции:
2) Рассчитаем
массу и количество вещества сульфата алюминия, содержащегося в растворе:
3) Определим массу осадка:
по уравнению реакции
Ответ: 11,184 г.
Слайд 29
Тур № 5,
определяющий победителя
Установите соответствие между веществами и реактивом,
с помощью которого их можно отличить. Напишите молекулярные уравнения реакций.
Вещества
А) карбонат натрия и сульфат натрия
Б) хлорид алюминия и хлорид калия
В) сульфат аммония и сульфат лития
Г) карбонат натрия и силикат натрия
Реактивы
1) гидроксид меди (II)
2) натрий
3) соляная кислота
4) бромная вода
5) гидроксид калия
Слайд 30
Тур № 5
Ответ
Карбонат натрия при взаимодействии с соляной кислотой
выделит углекислый газ;
Хлорид алюминия образует нерастворимый гидроксид в реакции с гидроксидом калия;
Сульфат аммония перейдет в водный раствор аммиака при взаимодействии с гидроксидом калия;
Силикат натрия образует нерастворимую кремниевую кислоту при взаимодействии с соляной кислотой.
Хлорид алюминия образует нерастворимый гидроксид в реакции с гидроксидом калия;
Сульфат аммония перейдет в водный раствор аммиака при взаимодействии с гидроксидом калия;
Силикат натрия образует нерастворимую кремниевую кислоту при взаимодействии с соляной кислотой.