- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Изменение степеней окисления атома углерода в органической химии
Содержание
- 1. Изменение степеней окисления атома углерода в органической химии
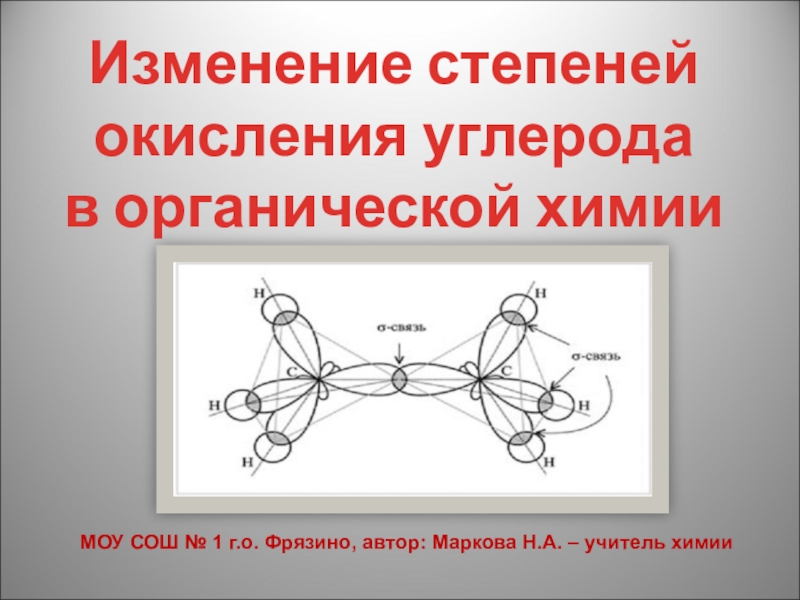
- 2. Как известно, углерод в органической химии четырехвалентен.
- 3. При изучении темы “Алканы” показываем, что процессы
- 4. Уравнение № 2 С2-2Н4+1 +
- 5. Уравнение № 33C-3H3+1—C0 = C-2H2+1 +
- 6. В аналогичном плане рассматриваем окисление ацетилена и
- 7. Уравнение № 5 С-2H3+1O-2H+1 +
- 8. Уравнение № 6 С0H2+1O-2 +
- 9. Особое внимание уделяем окислению метаналя аммиачным раствором
- 10. Уравнение № 8 H2+1C2+3O4-2 +
- 11. 1. Гомологи бензола с одной боковой
- 12. Уравнение № 9 С6H4(C-3H3+1)2 +
- 13. С6H5C-2H2+1C-3H3+1 +
- 14. С6H5C-1H2+1O-2H+1 + K2Cr2+6O7 +
- 15. Уравнение № 12 Окисление углеводов C60H12O6
- 16. Уравнение № 13 С120H22O11 +
- 17. Составьте уравнение реакции окисления бутена-1, если одним
- 18. Список литературы:Г. П. Хомченко, поступающим в вузы.
- 19. Удачи в познании !
Слайд 1Изменение степеней окисления углерода
в органической химии
МОУ СОШ № 1 г.о. Фрязино,
Слайд 2Как известно, углерод в органической химии четырехвалентен.
Но степень окисления углерода
Наша цель научить старшеклассников правильно и быстро определять степени окисления атома углерода в различных окислительно-восстановительных реакциях. Приведем примеры наиболее часто встречающихся ОВР для тренировки и подготовки к ЕГЭ по химии. Полученные навыки составления уравнений ОВР для углеводородов позволяют использовать их при изучении раздела “Кислородсодержащие соединения”.
Слайд 3При изучении темы “Алканы” показываем, что процессы окисления, горения, галогенирования, нитрования,
Уравнение № 1
C-3H3- CH3 + HN+5O3 CH3 – C-1H2 – N+3O2
+ H2O
C-3 - 2e ------ C-1
N+5 + 2e ------ Mn+3
1 окислитель
1 восстановитель
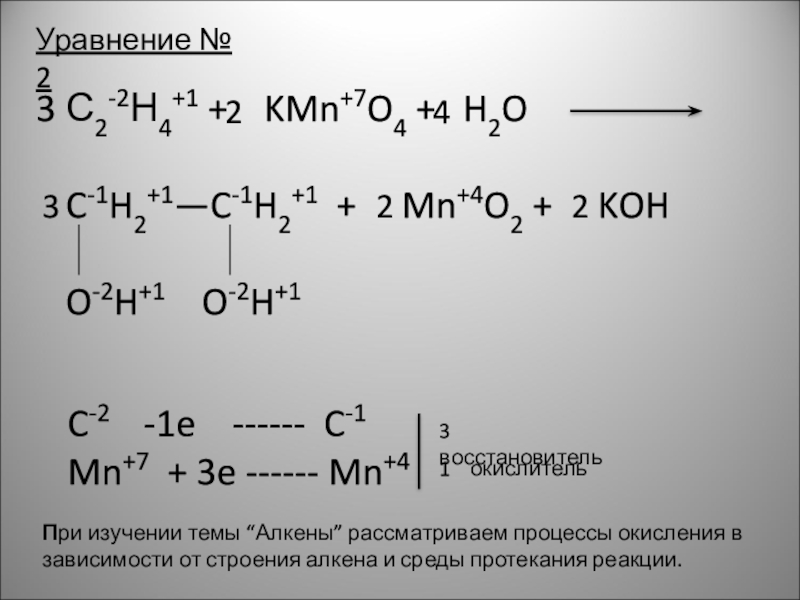
Слайд 4Уравнение № 2
С2-2Н4+1 + KMn+7O4 + H2O
O-2H+1 O-2H+1
C-2 -1e ------ C-1
Mn+7 + 3e ------ Mn+4
3 восстановитель
1 окислитель
3
2
4
3
2
2
При изучении темы “Алкены” рассматриваем процессы окисления в зависимости от строения алкена и среды протекания реакции.
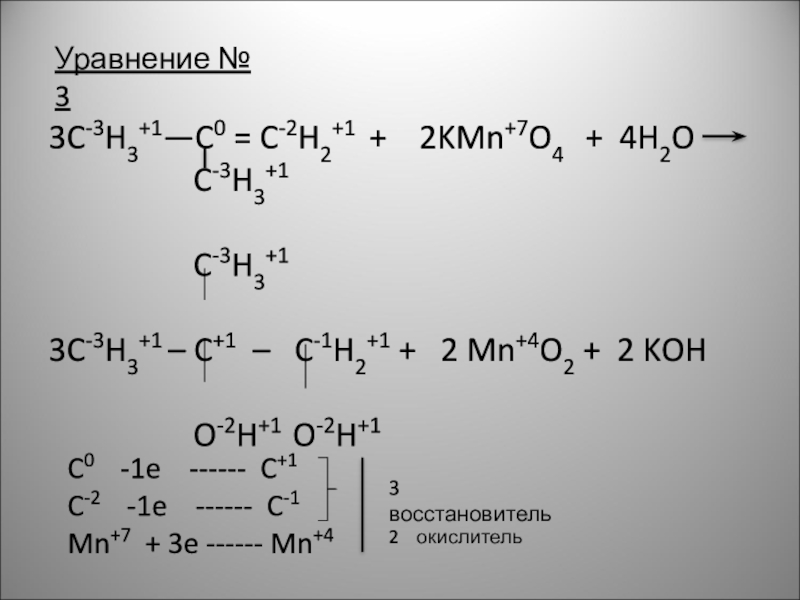
Слайд 5Уравнение № 3
3C-3H3+1—C0 = C-2H2+1 + 2KMn+7O4 + 4H2O
C-3H3+1
3C-3H3+1 – C+1 – C-1H2+1 + 2 Mn+4O2 + 2 KOH
O-2H+1 O-2H+1
C0 -1e ------ C+1
C-2 -1e ------ C-1
Mn+7 + 3e ------ Mn+4
3 восстановитель
2 окислитель
Слайд 6В аналогичном плане рассматриваем окисление ацетилена и его гомологов в зависимости
В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты).
HC-1 = C-1H + KMn+7O4 K2+1C2+3O4-2
+ Mn+4O2
C-1 -2e ------ C+3
Mn+7 + 3e ------ Mn+4
3 восстановитель
2 окислитель
3
6
3
6
Уравнение № 4
Слайд 7Уравнение № 5
С-2H3+1O-2H+1 + K2Cr2+6O7 +
H+1C+2O-2O-2H+1 + Cr2+3(SO4)3 + K2SO4
+ H2O
C-2 - 4e ------ C+2
2Cr+6 + 6e ------ 2Cr+3
3 восстановитель
2 окислитель
3
2
8
3
2
2
11
Первичные спирты при окислении в зависимости от условий протекания реакции могут образовать не только альдегиды, но и кислоты.
Слайд 8Уравнение № 6
С0H2+1O-2 + KMn+7O4 +
H+1C+2O-2O-2H+1 + Mn+2SO4 + K2SO4 + H2O
C0 -2e ------ C+2
Mn+7 + 5e ------ Mn+2
5 восстановитель
2 окислитель
5
2
3
5
2
3
Альдегиды легче, чем спирты, окисляются в соответствующие карбоновые кислоты.
Слайд 9Особое внимание уделяем окислению метаналя аммиачным раствором оксида серебра, т.к. в
HC0HО + 4[Ag+1(NH3)2]OH (NH4)2C+4O3 + 4Ag0 + 6NH3 + 2H2O.
C0 - 4e ------ C+4
Ag+1 + 1e ------ Ag0
1 восстановитель
4 окислитель
Слайд 10Уравнение № 8
H2+1C2+3O4-2 + KMn+7O4
+ Mn+4O2 + H2O
2C+3 -2e ------ 2C+4
Mn+7 + 3e ------ Mn+4
3
2
5
2
3
3 восстановитель
2 окислитель
Слайд 11 1. Гомологи бензола с одной боковой цепью (независимо от ее
-углеродному атому. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
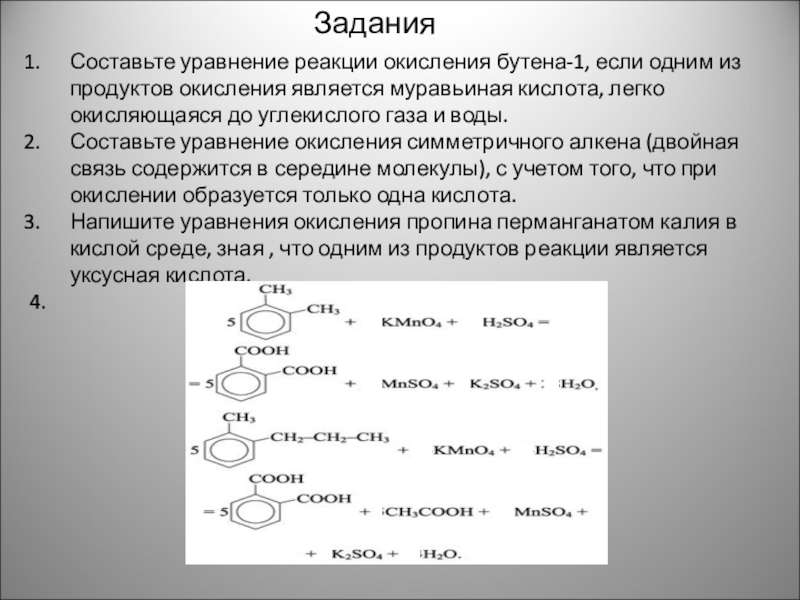
5C6H5–CH3 + 6KMnO4 + 9H2SO4 = 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O;
5C6H5–C2H5 + 12KMnO4 + 18H2SO4 = 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O;
C6H5–CH3 + 2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O.
2. Если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a- углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
Окисление гомологов бензола
Слайд 12Уравнение № 9
С6H4(C-3H3+1)2 + KMn+7O4 +
C6H4(C+3O-2O-2H+1) 2 + Mn+2SO4 + K2SO4
+ H2O
5
12
18
5
12
6
28
2C-3 -12e ------ 2C+3
Mn+7 + 3e ------ Mn+5
5 восстановитель
12 окислитель
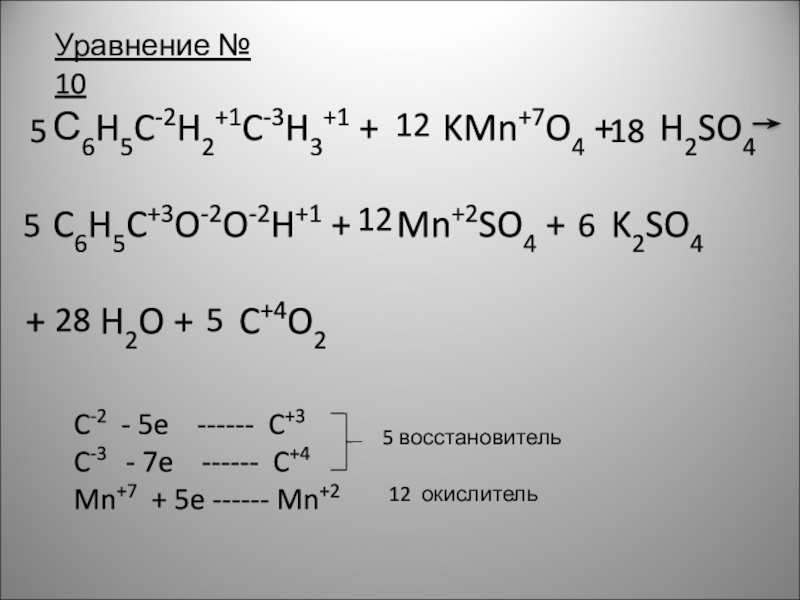
Слайд 13 С6H5C-2H2+1C-3H3+1 + KMn+7O4 +
C6H5C+3O-2O-2H+1 + Mn+2SO4 + K2SO4
+ H2O + C+4O2
Уравнение № 10
5
12
18
5
12
6
28
5
C-2 - 5e ------ C+3
C-3 - 7e ------ C+4
Mn+7 + 5e ------ Mn+2
5 восстановитель
12 окислитель
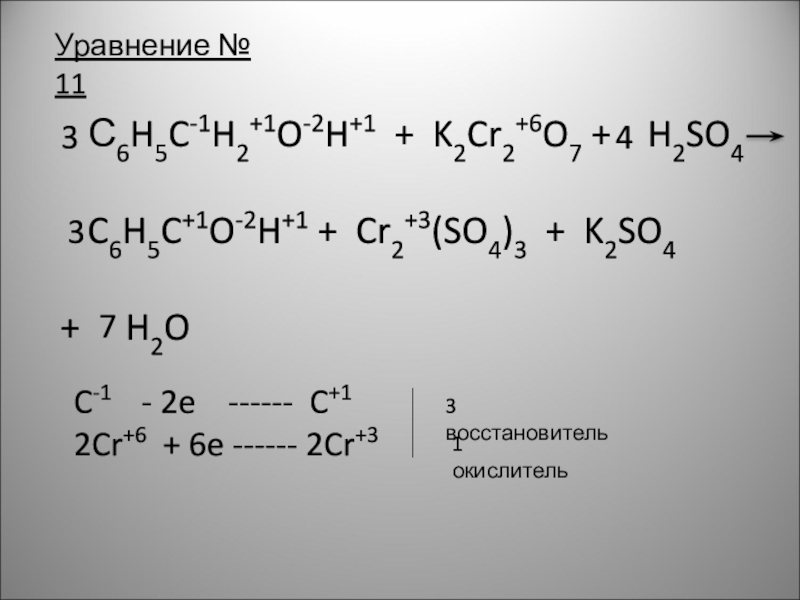
Слайд 14 С6H5C-1H2+1O-2H+1 + K2Cr2+6O7 + H2SO4
+ H2O
Уравнение № 11
C-1 - 2e ------ C+1
2Cr+6 + 6e ------ 2Cr+3
3 восстановитель
1 окислитель
3
4
3
7
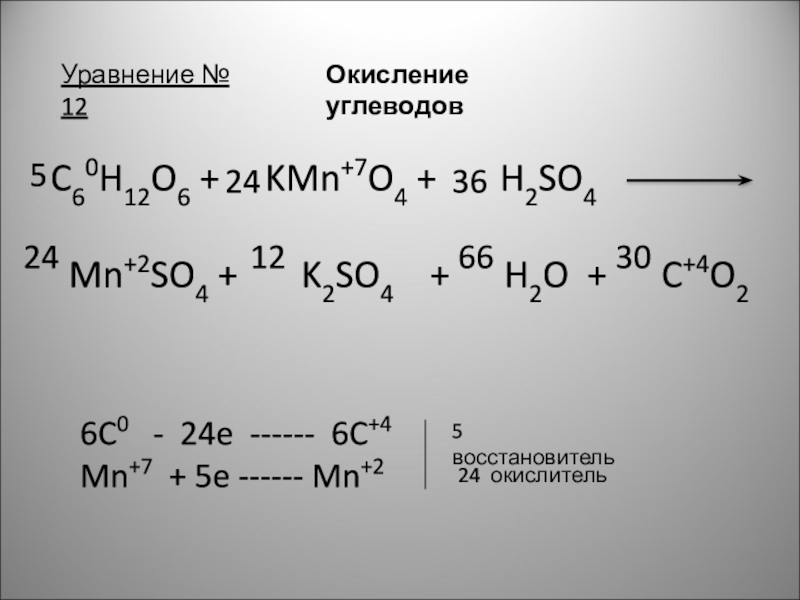
Слайд 15Уравнение № 12
Окисление углеводов
C60H12O6 + KMn+7O4
Mn+2SO4 + K2SO4 + H2O + C+4O2
6C0 - 24e ------ 6C+4
Mn+7 + 5e ------ Mn+2
5 восстановитель
24 окислитель
5
24
36
24
12
66
30
Слайд 16Уравнение № 13
С120H22O11 + K2Cr2+6O7 +
C+4O2 + Cr2+3(SO4)3 + K2SO4 + H2O
12C0 - 48 e -----12C+4
2Cr+6 + 6e ------ 2Cr+3
1 восстановитель
8 окислитель
5
24
48
60
24
24
103
Слайд 17Составьте уравнение реакции окисления бутена-1, если одним из продуктов окисления является
Составьте уравнение окисления симметричного алкена (двойная связь содержится в середине молекулы), с учетом того, что при окислении образуется только одна кислота.
Напишите уравнения окисления пропина перманганатом калия в кислой среде, зная , что одним из продуктов реакции является уксусная кислота.
4.
Задания
Слайд 18Список литературы:
Г. П. Хомченко, поступающим в вузы. Высшая школа, 2006.
Н.Е. Кузьменко,
Ю.Н. Медведев, подготовка к ЕГЭ. Экзамен, 2015 г.
А.а. Каверина, готовимся к ЕГЭ. Экзамен, 2015 г.
http://go.mail.ru/search?mailru.
http://grani.ru/Techno/m.156330.html.