- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Идем на урок химии: Сероводород (2015 г)
Содержание
- 1. Идем на урок химии: Сероводород (2015 г)
- 2. Сероводород— бесцветный газ с запахом тухлых яиц
- 3. В природе встречается в воде минеральных источников,
- 4. Строение.
- 5. Химические свойства:В воде сероводород мало растворим, водный
- 6. Серебро при контакте с сероводородом чернеет:4Ag +
- 7. СульфидыСоли сероводородной кислоты называют сульфидами. В воде
- 8. Пирит.
- 9. Халькопирит.
- 10. Киноварь.
- 11. Получение. С водородом сера в обычных условиях
- 12. Удобный способ получения Н2S состоит в нагревании
- 13. Очень чистый сероводород может быть получен пропусканием
- 14. ПрименениеСероводород из-за своей токсичности находит ограниченное применение:В
- 15. Серово-дород-ные ванны
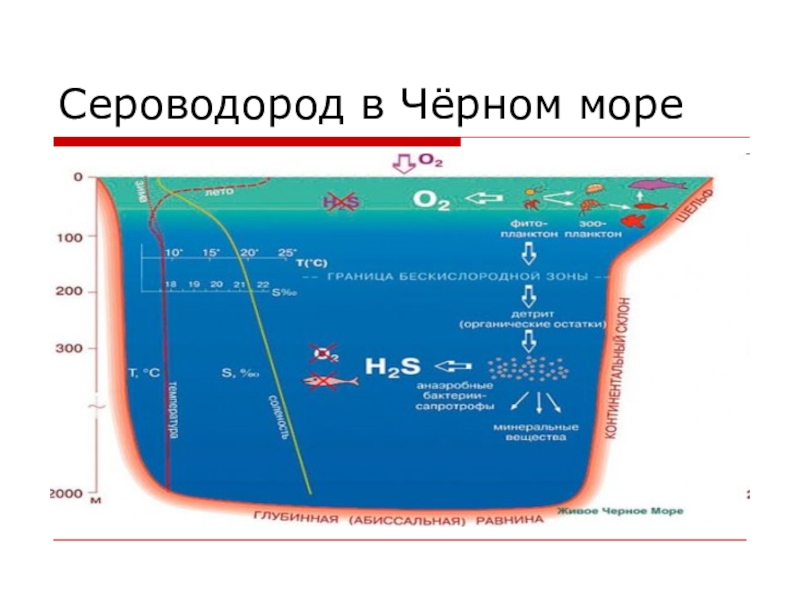
- 16. Сероводород в Чёрном море
- 17. Биологическая активностьОчень токсичен. Вдыхание воздуха с содержанием
- 18. Сероводород — сильный яд, вызывающий острые и
- 19. головная боль головокружениестеснение в грудитошнотарвотапонос иногда потеря сознания судороги При концентрации 0,02—0,2 мг/л наблюдается:
- 20. При концентрации выше 0,2 мг/л утрачивается обоняние,
- 21. Первая медицинская помощьудаление пострадавшего из загрязненной атмосферывдыхание
- 22. Профилактикадостаточная вентиляция герметизация некоторых производственных операций. Предельно
- 23. Ученые: Сероводород может спасти жизнь.Ученые использовали сероводород,
- 24. http://ru.wikipedia.org/wiki/H2Shttp://schoolchemistry.by.ru/katalog/serovodorod.htmhttp://allchem.ru/pages/encyclopedia/4661http://www.xumuk.ru/encyklopedia/2/4265.htmlhttp://www.catalogmineralov.ru/article/98.htmlhttp://www.catalogmineralov.ru/article/347.htmlhttp://www.supernovum.ru/forum/read.php?1,285368http://www.mguts.ru/technologyhttp://www.catalogmineralov.ru/mineral/2703.htmlhttp://tabulorasa.info/91937-yadovitoe-more.htmlhttp://www.medical-enc.ru/17/serovodorod.shtmlhttp://pariomsk.ru/Uchenie_Serovodorod_mozhet_spasti_zhizn.html
Сероводород— бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает металл. Взрывчатая смесь с воздухом 4,5 — 45 %.В
Слайд 2Сероводород— бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Химическая
формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает металл. Взрывчатая смесь с воздухом 4,5 — 45 %.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканического пепла.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканического пепла.
Молекула H2S
Слайд 3В природе встречается в воде минеральных источников, морей, вулканических газах. Образуется
при разложении белков без доступа кислорода. Может выделяться в воздух в ряде производств химической, текстильной и кожевенной промышленности, при добыче и переработке нефти, а также из канализационной сети.
Слайд 5Химические свойства:
В воде сероводород мало растворим, водный раствор H2S является очень
слабой кислотой:
H2S → HS− + H+ Ka = 6.9×10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
H2S → HS− + H+ Ka = 6.9×10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Слайд 6Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 =
2Ag2S + 2H2O
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2HO
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2HO
Слайд 7Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды
щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Слайд 11Получение.
С водородом сера в обычных условиях не соединяется. Лишь при
нагревании протекает обратимая реакция:
Н2 + S = Н2S + 21 кДж
равновесие которой около 350 °С смещено вправо, а при повышении температуры смещается влево. Практически сероводород получают обычно действием разбавленных кислот на сульфид железа:
FeS + 2 HСl = FeCl2 + Н2S
Н2 + S = Н2S + 21 кДж
равновесие которой около 350 °С смещено вправо, а при повышении температуры смещается влево. Практически сероводород получают обычно действием разбавленных кислот на сульфид железа:
FeS + 2 HСl = FeCl2 + Н2S
Слайд 12Удобный способ получения Н2S состоит в нагревании выше 170 °С сплава
порошкообразной серы с парафином и измельченным асбестом (приблизительно 3 : 5 : 2 по массе). При охлаждении реакция прекращается, но вновь вызывается нагреванием. Исходный сплав может заготовляться впрок и расходоваться по мере надобности (один грамм дает около 150 мл Н2S).
Слайд 13Очень чистый сероводород может быть получен пропусканием смеси Н2 с парами
серы над нагретыми до 600 °С кусками пемзы. Критическая температура Н2S равна 100 °С при критическом давлении 89 атм. Термическая диссоциация Н2S начинается приблизительно с 400 °С и становится практически полной около 1700 °С.
Сульфгидрильные группы (HS) входят в состав некоторых биологически важных органических соединений.
Сульфгидрильные группы (HS) входят в состав некоторых биологически важных органических соединений.
Пемза
Слайд 14Применение
Сероводород из-за своей токсичности находит ограниченное применение:
В аналитической химии сероводород и
сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Слайд 17Биологическая активность
Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает головокружение, головную
боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус.
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
Слайд 18Сероводород — сильный яд, вызывающий острые и хронические отравления. Оказывает местное
раздражающее и общетоксическое действие. При концентрации 1,2 мл/л отравление развивается молниеносно, смерть наступает вследствие острого угнетения процессов тканевого дыхания. При прекращении воздействия даже при тяжелых формах отравления пострадавший может быть возвращен к жизни.
Слайд 19
головная боль
головокружение
стеснение в груди
тошнота
рвота
понос
иногда потеря сознания
судороги
При концентрации
0,02—0,2 мг/л наблюдается:
Слайд 20При концентрации выше 0,2 мг/л утрачивается обоняние, в связи с чем
возрастает опасность отравлений, т. к. задерживается своевременный выход из загрязненной атмосферы.
Слайд 21Первая медицинская помощь
удаление пострадавшего из загрязненной атмосферы
вдыхание кислорода
искусственное дыхание
средства, возбуждающие
дыхательный центр (1% раствор лобелина 1 мл)
согревание тела.
согревание тела.
Слайд 22Профилактика
достаточная вентиляция
герметизация некоторых производственных операций.
Предельно допустимая концентрация в воздухе
рабочих помещений 10 мг/м3; в смеси с углеводородами — 3 мг/м3.
При спуске рабочих в колодцы и емкости, содержащие сероводород, они должны обязательно пользоваться противогазами и спасательными поясами на тросах.
Обязательна газоспасательная служба в шахтах, в местах добычи и на предприятиях по переработке нефти.
При спуске рабочих в колодцы и емкости, содержащие сероводород, они должны обязательно пользоваться противогазами и спасательными поясами на тросах.
Обязательна газоспасательная служба в шахтах, в местах добычи и на предприятиях по переработке нефти.
Слайд 23Ученые: Сероводород может спасти жизнь.
Ученые использовали сероводород, чтобы вызвать состояние гибернации,
подобное зимней спячке, чтобы снизить смертность из-за недостаточного кровоснабжения органов и тканей при летальной кровопотере у крыс. В эксперименте 75% крыс, вдыхавших сероводород, и 67% крыс, получавших его внутривенно, выжили в течение двух недель после того, как потеряли более половины всей крови организма. В двух контрольных группах, не получавших сероводород, выжили при такой кровопотере лишь 23% и 14% крыс.
Никаких функциональных и поведенческих отклонений у выживших в эксперименте крыс выявлено не было. Более того, они произвели на свет нормальное здоровое потомство.
Никаких функциональных и поведенческих отклонений у выживших в эксперименте крыс выявлено не было. Более того, они произвели на свет нормальное здоровое потомство.