- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Идем на урок химии: Повторяем тему кислоты.
Содержание
- 1. Идем на урок химии: Повторяем тему кислоты.
- 2. ОпределениеКисло́ты — сложные вещества, которые состоят из
- 3. История открытияВ 1778 французский химик Антуан Лавуазье
- 4. Наиболее распространены три теории кислотПо теории сольвосистем,
- 5. Классификация кислотПо содержанию кислородабескислородные (HCl, H2S)кислородосодержащие (HNO3)
- 6. По основности — количество кислых атомов водородаОдноосновные (HNO3)Двухосновные (H2SeO4)Трёхосновные (H3PO4, H3NO4)Четырёхосновные (H4CO4).
- 7. По силеСильные — диссоциируют практически полностью, константы
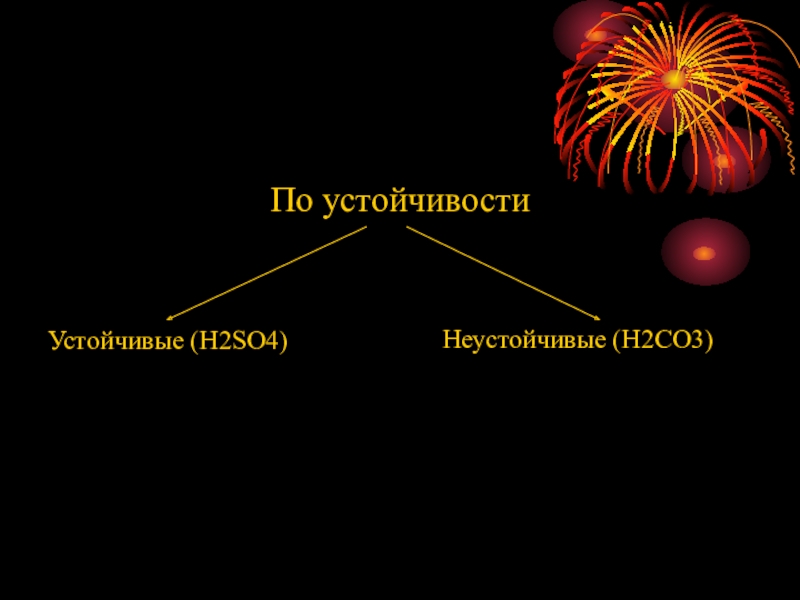
- 8. По устойчивостиУстойчивые (H2SO4)Неустойчивые (H2CO3)
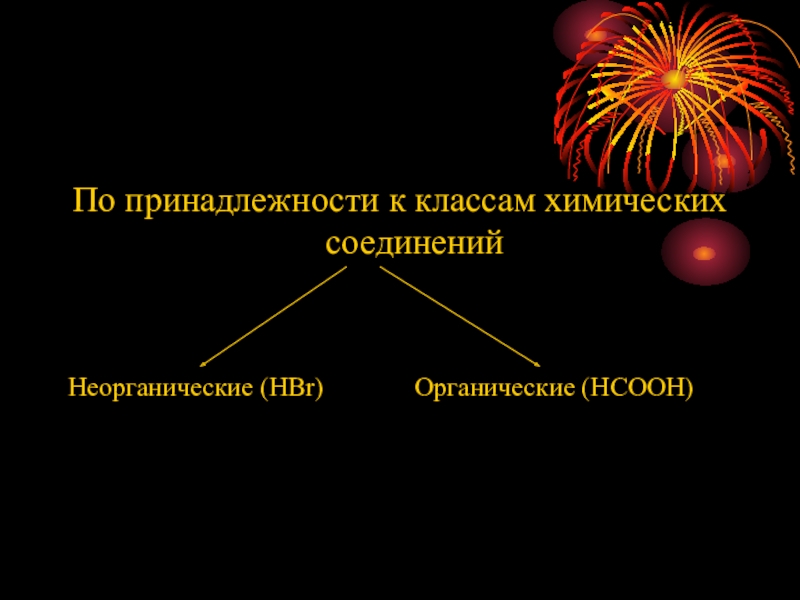
- 9. По принадлежности к классам химических соединенийНеорганические (HBr)Органические (HCOOH)
- 10. По летучестиЛетучие (H2S, HCl)Нелетучие (H2SO4)
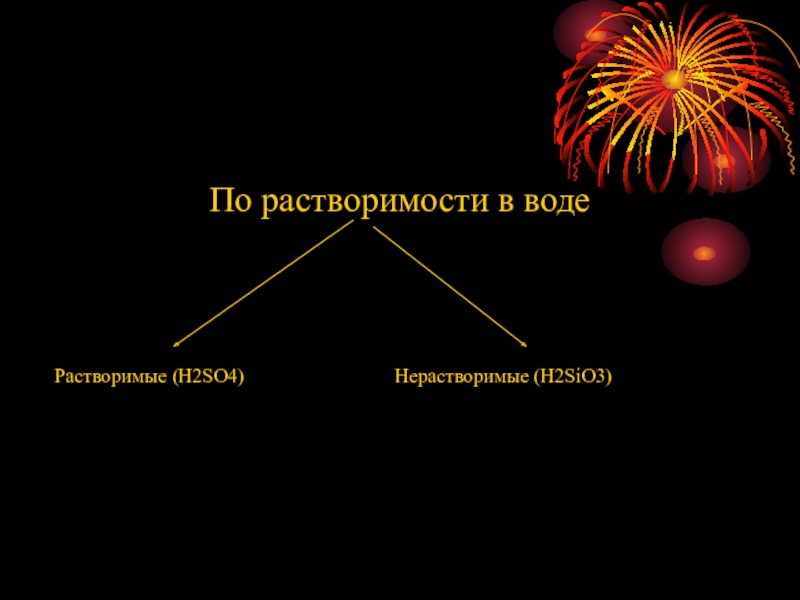
- 11. По растворимости в водеРастворимые (H2SO4)Нерастворимые (H2SiO3)
- 12. Химические свойства кислотВзаимодействие с оксидами металлов с
- 13. Взаимодействие с солями, если выпадает осадок или
- 14. Промышленное производство HNO3Производство азотной кислотыСовременный способ её
- 15. Промышленное производство H2SO4Уравнение реакции первой стадииt =
- 16. Охрана окружающей средыВ зоне до 300 км
- 17. Соляная кислота: влияние на экологию и здоровье
- 18. При попадании соляной кислоты на кожные покрытия
- 19. Безопасность и охрана здоровьяВезде, где это возможно,
- 20. Индивидуальная защита. Люди, сталкивающиеся с брызгами минеральных
ОпределениеКисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и
Слайд 2Определение
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться
на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.
В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.
Слайд 3История открытия
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства
обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+).
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+).
Слайд 4Наиболее распространены три теории кислот
По теории сольвосистем, начало которой положили работы
американских химиков Кэди и Франклина, опубликованные в 1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О+, NH4+). Это определение хорошо тем, что не привязано к водным растворам.
По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты.
По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар. Таким образом, в теории Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью.
По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты.
По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар. Таким образом, в теории Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью.
Слайд 5Классификация кислот
По содержанию кислорода
бескислородные (HCl, H2S)
кислородосодержащие (HNO3)
Слайд 6
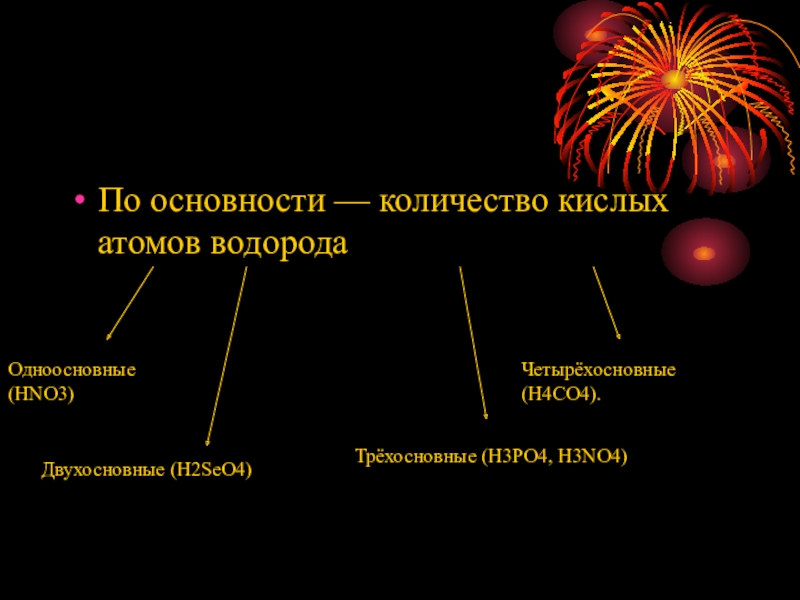
По основности — количество кислых атомов водорода
Одноосновные (HNO3)
Двухосновные (H2SeO4)
Трёхосновные (H3PO4, H3NO4)
Четырёхосновные
(H4CO4).
Слайд 7
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1×10−3 (HNO3)
Слабые
— константа диссоциации меньше 1×10−3 (уксусная кислота Kд= 1,7×10−5).
Слайд 12Химические свойства кислот
Взаимодействие с оксидами металлов с образованием соли и воды:
Взаимодействие
со щелочами с образованием соли и воды (реакция нейтрализации):
Слайд 13Взаимодействие с солями, если выпадает осадок или выделяется газ:
Сильные кислоты вытесняют
более слабые из их солей:
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты ), если образующаяся соль растворима
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
Слайд 14Промышленное производство HNO3
Производство азотной кислоты
Современный способ её производства основан на каталитическом
окислении синтетического аммиака на платино-родиевых катализаторах (метод Габера) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
Слайд 15Промышленное производство H2SO4
Уравнение реакции первой стадии
t = 800°C
4FeS2 + 11O2 2Fe2O3
+ 8SO2 + Q
ВТОРАЯ СТАДИЯ - окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2=2SO3 + Q
ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой.
Уравнение реакции этого процесса
nSO3 + H2SO4= H2SO4·nSO3
ВТОРАЯ СТАДИЯ - окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2=2SO3 + Q
ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой.
Уравнение реакции этого процесса
nSO3 + H2SO4= H2SO4·nSO3
Слайд 16Охрана окружающей среды
В зоне до 300 км от источника загрязнения (SO2)
опасность представляет серная кислота, в зоне до 600 км. - сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление водоемов (весной при таянии снега, вызывает гибель молоди рыб. Помимо экологического ущерба налицо экономический ущерб - громадные суммы каждый год теряются при раскисление почв.
Слайд 17Соляная кислота: влияние на экологию и здоровье человека.
Соляная кислота (хлористоводородная кислота)
– водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
Слайд 18
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть
обильной струей воды. Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Слайд 19Безопасность и охрана здоровья
Везде, где это возможно, агрессивные кислоты должны заменяться
другими, представляющими меньшую опасность; необходимо использовать минимально допустимую для процесса концентрацию. При применении минеральных кислот должны соблюдаться соответствующие меры безопасности при хранении, транспортировке, утилизации, а также обеспечиваться необходимая вентиляция, индивидуальные средства защиты и меры первой помощи.
Хранение. Помещения для хранения кислот должны быть изолированы от других, иметь хорошую вентиляцию и защиту от солнечного света и источников тепла; они должны иметь цементный пол и не содержать материалов, с которыми могла бы вступать в реакцию кислота.
Транспортировка. Кислоты должны подаваться через герметичные системы, чтобы исключить возможность контакта с ними.
Хранение. Помещения для хранения кислот должны быть изолированы от других, иметь хорошую вентиляцию и защиту от солнечного света и источников тепла; они должны иметь цементный пол и не содержать материалов, с которыми могла бы вступать в реакцию кислота.
Транспортировка. Кислоты должны подаваться через герметичные системы, чтобы исключить возможность контакта с ними.
Слайд 20Индивидуальная защита. Люди, сталкивающиеся с брызгами минеральных кислот, должны пользоваться кислотоустойчивыми
средствами индивидуальной защиты: предохраняющими руки, глаза, лицо, применять фартуки, комбинезоны и защитные костюмы.
Неотложная помощь. При попадании кислот на кожу или в глаза следует немедленно и обильно промыть проточной водой. Поэтому в помещениях должны быть предусмотрены души, фонтанчики для промывки глаз, ванны или резервуары с водой. Необходимо снять загрязненную одежду и выполнить процедуру обработки кожи.
Людей, вдохнувших пары кислот, необходимо немедленно удалить из загрязненной зоны, обеспечить покой и оказать медицинскую помощь. При случайном глотании кислоты необходимо дать нейтрализующее вещество и промыть желудок. Не следует искусственно вызывать рвоту.
В дополнение к общим мерам, описанным выше, кислоту не следует хранить в непосредственной близости от горючих веществ или окислителей, а также рядом с металлами и металло- гидридами, которые могут вступать в реакцию с кислотой с выделением водорода. Взрывоопасные концентрации водорода в воздухе составляют от 4 до 75 объемных процентов. Электрооборудование должно иметь взрывобезопасное исполнение и быть защищено от разъедающего действия паров кислоты.
Неотложная помощь. При попадании кислот на кожу или в глаза следует немедленно и обильно промыть проточной водой. Поэтому в помещениях должны быть предусмотрены души, фонтанчики для промывки глаз, ванны или резервуары с водой. Необходимо снять загрязненную одежду и выполнить процедуру обработки кожи.
Людей, вдохнувших пары кислот, необходимо немедленно удалить из загрязненной зоны, обеспечить покой и оказать медицинскую помощь. При случайном глотании кислоты необходимо дать нейтрализующее вещество и промыть желудок. Не следует искусственно вызывать рвоту.
В дополнение к общим мерам, описанным выше, кислоту не следует хранить в непосредственной близости от горючих веществ или окислителей, а также рядом с металлами и металло- гидридами, которые могут вступать в реакцию с кислотой с выделением водорода. Взрывоопасные концентрации водорода в воздухе составляют от 4 до 75 объемных процентов. Электрооборудование должно иметь взрывобезопасное исполнение и быть защищено от разъедающего действия паров кислоты.