- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Хром
Содержание
- 1. Хром
- 2. Актуальность: хром относится к микроэлементам, является
- 3. В 1766 году в окрестностях Екатеринбурга был
- 4. Месторождения хромаВ земной коре хрома довольно много
- 5. Нахождение хрома в природе Основные соединения хрома —
- 6. Положение хрома в ПСХЭ Д.И. Менделеева. периодгруппапорядковый
- 7. Физические свойстваМеталл серебристо-белого цветаСамый твердый металлХрупкий, с плотностью7,2 г/см3Тем.плавл.18900C
- 8. Чистый хром
- 9. Кристаллы хрома
- 10. Получение Из хромистого железняка Fe(CrO2)2 (хромита железа)
- 11. Химические свойстваLi,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
- 12. Cr0 + O20
- 13. В раскаленном состоянии хром реагирует с парами
- 14. Cr0 +
- 15. Cr0 + H2S+6O4 → Cr2+3(SO4)3 + S+4O2
- 16. В присутствии кислорода хром
- 17. Соединения хрома (II)CrOОксид хрома (II) – кристаллы
- 18. Cr(OH)2Гидроксид хрома (II)
- 19. Соединения хрома (III)Cr2O3Оксид хрома () – тугоплавкий
- 20. Гидроксид хрома (III)Cr(OH)3Получают гидроксид хрома (III) действиемрастворов
- 21. Получают CrO3 действием избытка
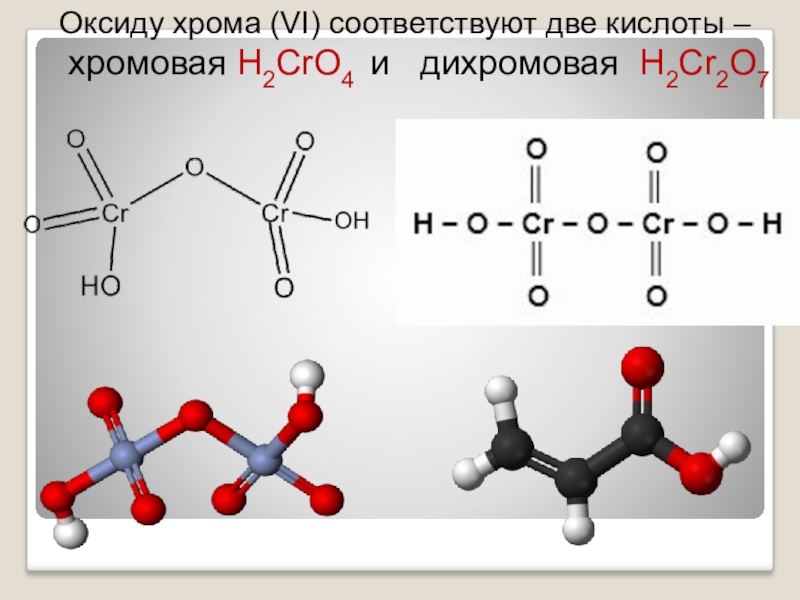
- 22. Оксиду хрома (VI) соответствуют
- 23. хроматы – соли хромовой кислоты устойчивы в
- 24. Роль хрома в живых организмахХром — один
- 25. Функции хрома в жизни человекаОсновная роль хрома
- 26. Пищевые источники хромапшеничные ростки, печень, мясо, сыр,
- 27. Применение хрома- для выплавки хромистых сталей. -
- 28. Применение хрома
- 29. Экспериментальная частьОборудование:штатив, пробирки, фильтровальная бумага, воронки,колбы, мерные
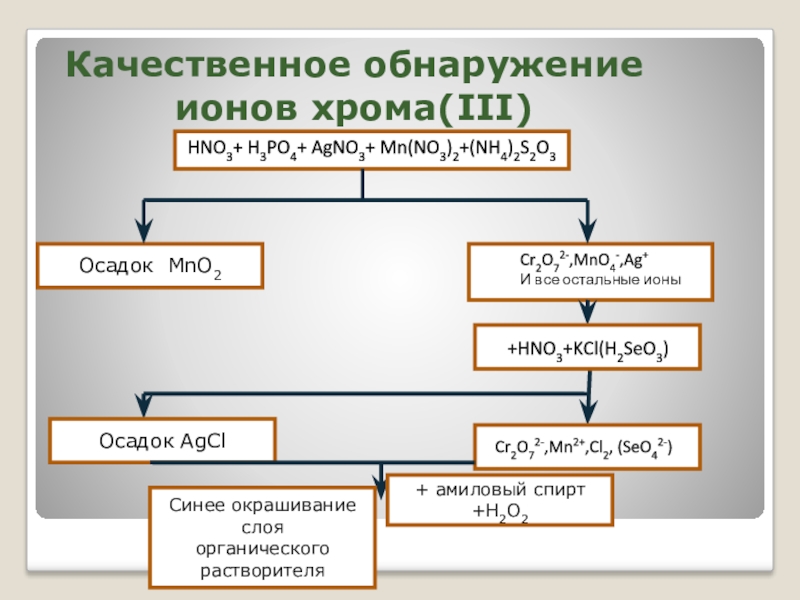
- 30. Качественное обнаружение ионов хрома(III)
- 31. Химреактивы для определения ионов хрома(III)
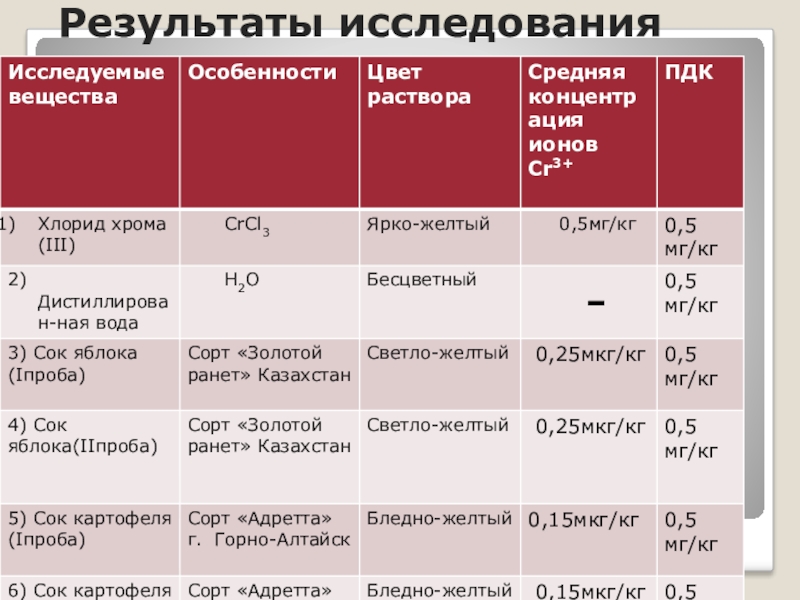
- 32. 1- хлорид хрома(III) 2- дистиллированная вода
- 33. Результаты опытов
- 34. Результаты исследования
- 35. Вывод Соединения хрома(III) являются участниками биохимических процессов.
Слайд 2
Актуальность: хром относится к микроэлементам, является участником биохимических процессов в
Гипотеза работы: я предполагаю, что в овощах и фруктах содержатся соединения хрома, которые влияют на организм человека.
Цель: определить содержатся ли соединения хрома в исследуемых овощах, фруктах.
Задачи:
Теоретически изучить значение хрома для биосистем.
Определить содержание соединений в овощах, фруктах.
На основе полученных данных сделать вывод.
Слайд 3
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил
В 1797 французский химик Л.Н.Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Слайд 4Месторождения хрома
В земной коре хрома довольно много – 0,02%. Хромовая руда
Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд есть и на Урале.
Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.
Слайд 5Нахождение хрома в природе
Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3.
хромит
крокоит
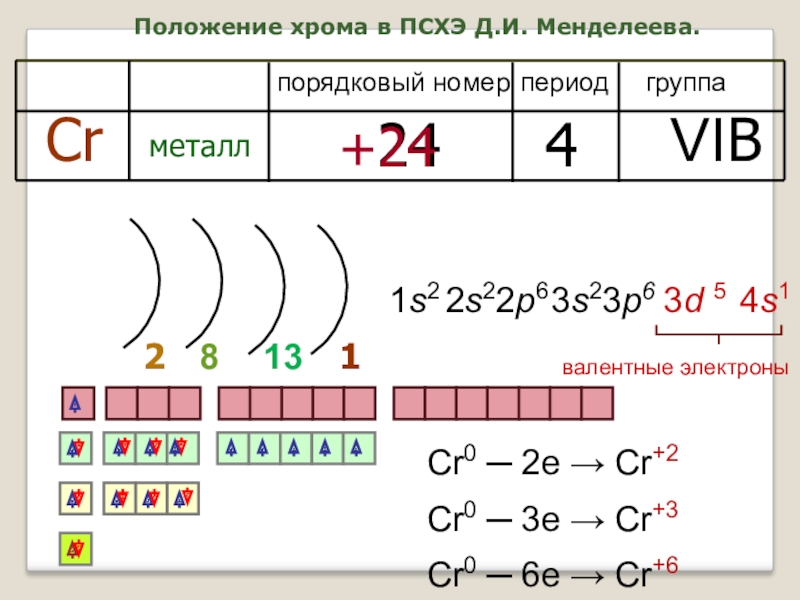
Слайд 6Положение хрома в ПСХЭ Д.И. Менделеева.
период
группа
порядковый номер
Cr
металл
24
4
VIB
+24
4
2
1
8
валентные электроны
13
1s2
2s22p6
4s1
3s23p6
3d 5
Cr0 ─
Cr0 ─ 3e → Cr+3
Cr0 ─ 6e → Cr+6
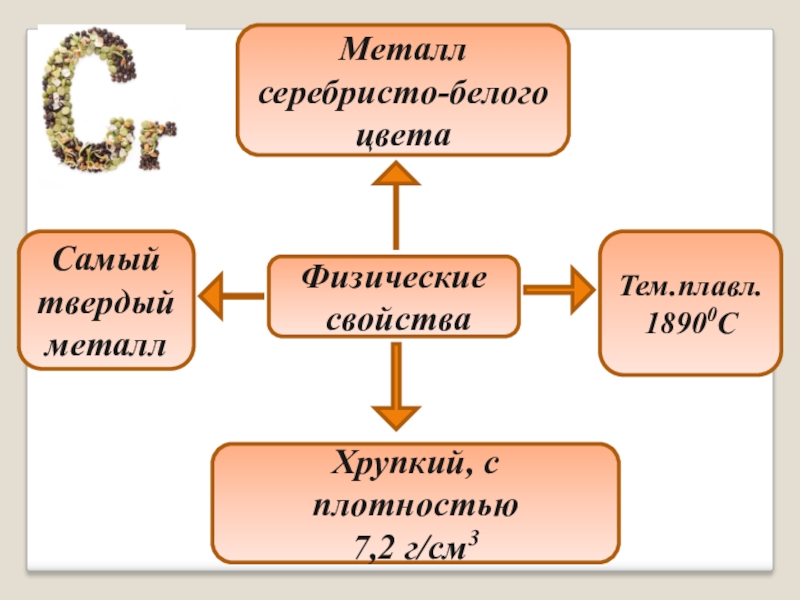
Слайд 7Физические
свойства
Металл серебристо-белого цвета
Самый твердый металл
Хрупкий, с плотностью
7,2 г/см3
Тем.плавл.
18900C
Слайд 10Получение
Из хромистого железняка Fe(CrO2)2 (хромита железа) получают феррохром восстановлением в
FeO· Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром — сплав железа и хрома (около 60% ),
основные примеси – углерод (до5%) кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для производства легированных
сталей.
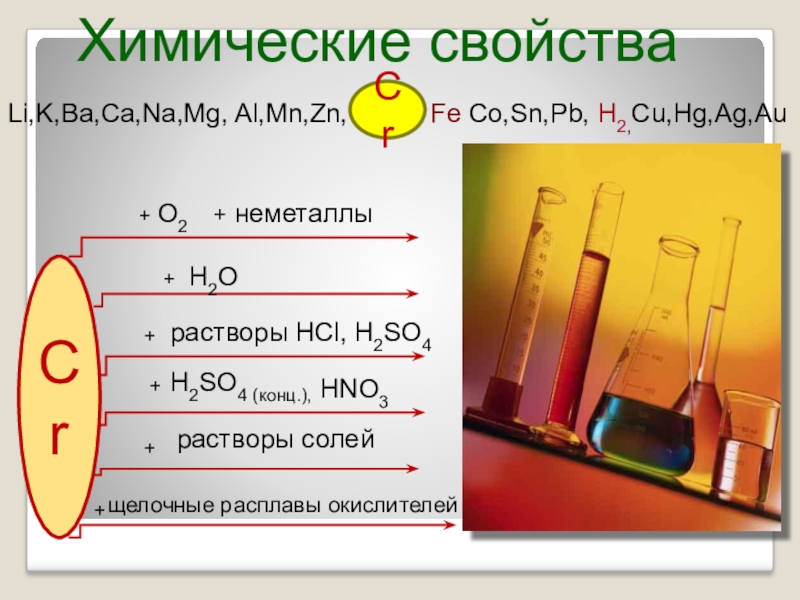
Слайд 11Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
Cr
Cr
+
+
+
+
H2SO4
растворы солей
+ неметаллы
О2
растворы HCl, H2SO4
H2O
+
щелочные расплавы окислителей
+
HNO3
Слайд 12 Cr0 + O20 = Cr2+3O3–2
4
2
3
Cr0 –
O20 + 4e → 2O–2 3
Cr0 – восстановитель, процесс окисления
O20 – окислитель, процесс восстановления
Cr0 + Br20 = Cr+3Br3–1
2
3
2
Cr0 – 3e → Cr+3 2
Br20 + 2e → 2Br–1 3
Cr0 – восстановитель, процесс окисления
Br20 – окислитель, процесс восстановления
Слайд 13В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O =
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
Cr
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).
Слайд 14 Cr0 + H+1Cl = Cr+2Cl2
Cr0 – 2e → Cr+2 1
2H+ + 2e → H20 1
2
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 + H2+1SO4 = Cr+2SO4 + H20
Cr0 – 2e → Cr+2 1
2H+ + 2e → H20 1
Cr0 – восстановитель, процесс окисления
H2SO4(за счет Н+1) – окислитель,
процесс восстановления
Слайд 15Cr0 + H2S+6O4 → Cr2+3(SO4)3 + S+4O2 + H2O
Cr0 + HN+5O3
Cr0 – 3e → Cr+3 2
S+6 + 2e → S+4 3
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O
Cr0 – восстановитель, процесс окисления
H2SO4 (за счет S+6) – окислитель, процесс восстановления
Cr0 – 3e → Cr+3 1
N+5 + 1e → N+4 3
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O
Cr0 – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, процесс восстановления
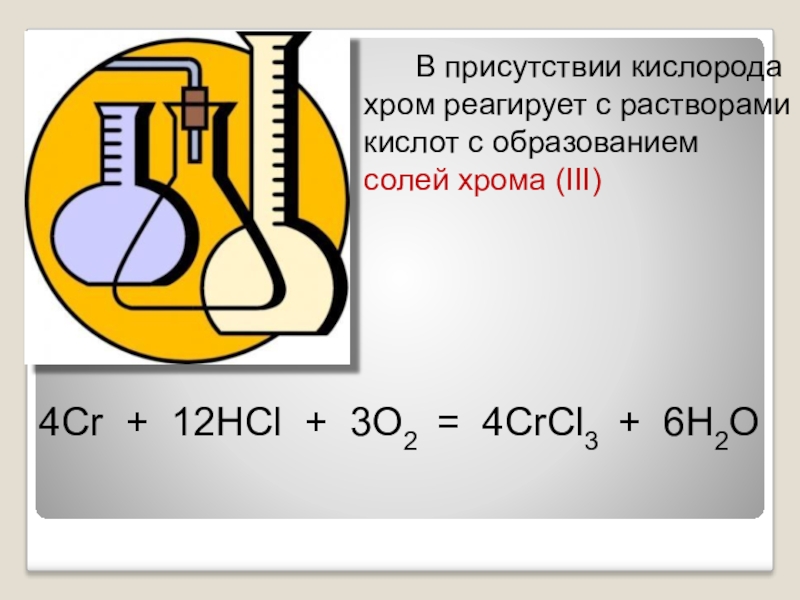
Слайд 16 В присутствии кислорода
хром реагирует с растворами
кислот
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
Слайд 17Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет основный
При осторожном нагревании
гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II).
Cr(OH)2 = CrO + H2O
3CrO = Cr + Cr2O3
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
Слайд 18Cr(OH)2
Гидроксид хрома (II)
Гидроксид хрома (II)
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
Слайд 19Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.
Получение.
В
дихромата аммония:
(NH4)2Cr2O7 = Cr2O3 + N2 + 2H2O
В промышленности восстановлением дихромата калия
коксом или серой:
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S = 2Cr2O3 + K2SO4
t°
t°
t°
Слайд 20Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на
солей хрома (III).
Гидроксид хрома (III) — амфотерный гидроксид. Серо-зелёного цвета, разлагается при нагревании. Не растворяется в воде.
CrCl3 + 3(NH3·H2O) = Cr(OH)3 + 3NH4Cl
Слайд 21 Получают CrO3 действием избытка
концентрированной
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
Оксид хрома (VI) очень ядовит.
4CrO3 → 2Cr2O3 + 3O2↑.
При нагревании выше 250 °C разлагается:
Оксид хрома (VI) CrO3 - хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
Слайд 23хроматы – соли хромовой кислоты устойчивы в щелочной среде, при
подкислении
дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается.
2CrO42– + 2H+ ↔ Cr2O72– + H2O
хроматы
дихроматы
соли
ОН–
Н+
Слайд 24Роль хрома в живых организмах
Хром — один из биогенных элементов, постоянно
У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов.
Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Слайд 25Функции хрома в жизни человека
Основная роль хрома в организме - это
Хром необходим для нормального
метаболизма жиров («сжигания жиров»)
в организме и его недостаток однозначно
ведет к излишнему весу, ожирению.
Слайд 26Пищевые источники хрома
пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно,
Слайд 27Применение хрома
- для выплавки хромистых сталей.
- декоративные коррозионно-стойкие покрытия.
-
- для сварочных электродов
- виде иона хром (III)- примесь в рубине
- лазерный материал
- протравливают ткани при крашении
- изготовляют хромомагнезитовые огнеупорные изделия
Слайд 29
Экспериментальная часть
Оборудование:
штатив, пробирки, фильтровальная бумага, воронки,
колбы, мерные цилиндры, спиртовка, спички, терка
Объект
сок картофеля, яблока
Предмет исследования:
ионы хрома (III)
Слайд 30Качественное обнаружение ионов хрома(III)
HNO3+ H3PO4+ AgNO3+ Mn(NO3)2+(NH4)2S2O3
Осадок MnO2
Cr2O72-,MnO4-,Ag+
И все остальные ионы
+HNO3+KCl(H2SeO3)
Осадок AgCl
Cr2O72-,Mn2+,Cl2, (SeO42-)
+ амиловый спирт +H2O2
Синее окрашивание слоя
органического растворителя