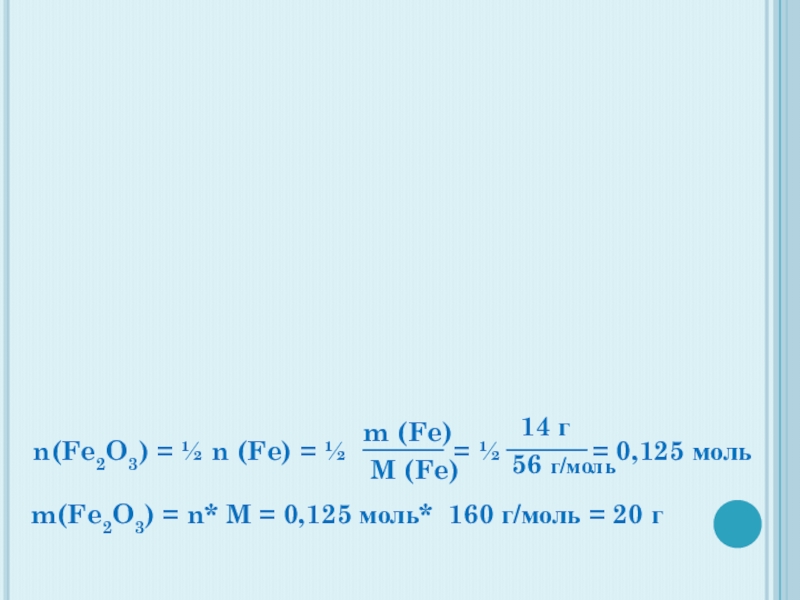- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химия пәнінең презентация. Тақырыбы: Өнімнің шығымы.
Содержание
- 1. Химия пәнінең презентация. Тақырыбы: Өнімнің шығымы.
- 2. Реакция өнімдегі шығымның массалық үлесі (η –
- 3. формулалары арқылы есептеледі η = m(пр.) /
- 4. Көп химиялық реакциялар толығымен, аяғына дейін жүрмейді.
- 5. «Заттың шығымы» түсінігімен байланысты есептердің үш типі
- 6. 1) Есептің шартың мұқият оқып шығу. 2)
- 7. 32,4г. мырыш оксидінең алюминийтермия әдісі
- 8. Берілгені: m(ZnO) = 32,4 г mпр(Zn)
- 9. Берілгені: Шешуі: m (ZnO) = 32,4 г
- 10. Берілгені:
- 11. 1. 32,4г. мырыш оксидінең алюминийтермия әдісі
- 12. 4. 234 г ас тұзына күкірт
- 13. 4. 234 г ас тұзына күкірт
- 14. 5. Массасы 120 г темір (ІІІ)
- 15. 5. Массасы 120 г темір (ІІІ)
- 16. 6. 1,7 г аммиак тұз қышқылымен
- 17. 6. 1,7 г аммиак тұз қышқылымен
- 18. Сергіту.
- 19. 7. Массасы 1г. сутек газын хлормен синтездеу
- 20. 11. Көлемі 44,8л. (қ.ж.) азотты сутекпен
- 21. 16. 45г. глюкоза сүт қышқылды ашыған
- 22. Үйге тапсырма. 11,2 г темір тұз қышқылымен
- 23. Слайд 23
- 24. 1) Есептің шартың мұқият оқып шығу. 2)
- 25. Теория жүзіндегімен салыстырғандағы шығымы 92%
- 26. 3) Реакция теңдеуің жазып, теңеструге ұмытпа. Берілгені:
- 27. 4. Реакция теңдеуі бойынша өнімнің теориялық массасың
- 28. 5) Өнімнің іс жүзіндегі массасың табу.
- 29. 2. Теория жүзіндегімен салыстырғандағы шығымы 92% болса,
- 30. Есептің үшінші типің шешу алгоритімі: 1) Есептің
- 31. 1. Есептің шартың мұқият оқып шығу. Теория
- 32. 3) Реакция теңдеуің жазып, теңеструге ұмытпа.
- 33. 4) Өнімнің теориялық массасын кері формула бойынша
- 34. 5) Реагенттің массасың есептендер. Берілгені:m
- 35. Слайд 35
- 36. n(Fe2O3) = ½ n (Fe) = ½
- 37. Сандық есептер №2.Тақырыбы: Теориялық мүмкіндікпен салыстыра отырып,
- 38. Егер шығымы 100 пайыз болса, 10г. алюминийді оттекте жаққанда алынған алюминий оксидінің массасы. (18г.)
Слайд 1Тақырыбы:
Теориялық мүмкіндікпен салыстыра отырып реакция өнімдегі шығымның массалық үлесін есептеу.
Слайд 2Реакция өнімдегі шығымның массалық үлесі
(η – «эта»)
(ω - «омега»)
__
реакция
Слайд 3формулалары арқылы есептеледі
η = m(пр.) / m(теор.) * 100%
η = V(пр.) / V(теор.) * 100%
(көлем бойынша) (2)
m(пр.) = m(теор.) * η
m(теор.) =
m(пр.)
η
Слайд 4Көп химиялық реакциялар толығымен, аяғына дейін жүрмейді.
Органикалық заттардың арасындағы реакцияларда, қейде
Гетерогенді реакция кезінде, кейдір заттар реакцияға түспей қалады.
Химиялық реакцияны жүргізген кезде, қолданып отырған кұрал-жабдықар маңызды рөл атқарады. Герметика жағынан, нашар қосылған құралдар, газ тәрізді заттың бір неше көлемін жоғалтады.
Неге?
… шынайы химиялық реакцияларда өнімнің массасы есептелген массадаң төмен болады.
Слайд 5«Заттың шығымы»
түсінігімен байланысты
есептердің үш типі бар.
1. Берілді:
Табу керек: өнімнің шығымың.
Берілді: реагенттің массасы және өнімнің шығымы.
Табу керек: өнімнің массасың.
Берілді: өнімнің массасы және шығымы.
Табу керек: реагенттің массасың.
Слайд 61) Есептің шартың мұқият оқып шығу.
2) Жазып ал: не берілді,
3) Реакция теңдеуің жазып, теңеструге ұмытпа.
4) Реакция теңдеуі бойынша өнімнің теориялық массасың табу.
5) Белгілі формула бойынша өнімнің шығымың есептеп алу. Жауабың жазу.
Есептің бірінші типің шешу алгоритімі:
Табу керек: өнімнің шығымың.
Слайд 7 32,4г. мырыш оксидінең алюминийтермия әдісі арқылы, 24г. таза мырыш
Берілді: Шешуі:
m(ZnO) = 32,4 г
mпр(Zn) = 24 г
Табу керек:
η шығ.(Zn) - ?
1. Есептің шартың мұқият оқы.
2. Жазып ал: не берілді, не табу керек?
Слайд 8Берілгені:
m(ZnO) = 32,4 г
mпр(Zn) = 24 г
Шешуі:
3. Реакция теңдеуің жазып,
теңеструге ұмытпа.
3ZnO + 2Al = 3Zn + Al2O3
Табу керек:
η шығ.(Zn) - ?
Слайд 9Берілгені: Шешуі:
m (ZnO) = 32,4 г 32,4 г
m пр (Zn) = 24 г 3ZnO + 2Al = 3Zn + Al2O3
3 моль 3 моль
Табу:
η шығ.(Zn) - ?
Теңдеу бойынша:
m теор.(Zn) = n.M = 0,4 моль* 65г/моль = 26 г.
(теория)
n (Zn) = n (ZnO) = = = 0,4 моль
m (ZnO)
M (ZnO)
32, 4 г
81 г/моль
4. Реакция теңдеуі бойынша өнімнің теориялық массасың табу.
Слайд 10Берілгені: Шешуі:
m (ZnO) =
m пр (Zn) = 24 г 3ZnO +2 Al =3 Zn + Al2O3
3 моль 3 моль
Табу:
η шығ.(Zn) - ? Теідеу бойынша:
m теор.(Zn) = n*M = 0,4 моль *65г/моль = 26 г. (теория)
5. Белгілі формула бойынша өнімнің шығымың есептеп ал. Жауабың жаз.
n (Zn) = n (ZnO) = = = 0,4 моль
m (ZnO)
M (ZnO)
32, 4 г
81 г/моль
η шығ.= = = 0, 92 (92%)
mпр( Zn)
mтеор (Zn)
24 г
26 г
Жауабы: 92% Zn
Слайд 111. 32,4г. мырыш оксидінең алюминийтермия әдісі арқылы, 24г. таза мырыш
3ZnO +2 Al =3 Zn + Al2O3
Слайд 124. 234 г ас тұзына күкірт қышқылымен әсер еткенде131,4 г
Слайд 134. 234 г ас тұзына күкірт қышқылымен әсер еткенде131,4 г
Шешуі:
2NaСІ + H2SO4→ Na2SO4 + 2HСІ
М(NaСІ) = 58,5 г/моль
m(NaСІ) = ν · М(NaСІ) = 2 моль · 58,5 г/моль = 117 г
М(HСІ) = 73 г/моль
m(HСІ) = ν · М(HСІ) = 1 моль · 73 г/моль = 73 г
х г HСІ---- 234 г NaСІ
73 г HСІ ---- 117 г NаСІ
х % ------ 131,4 г НСІ
100% ----- 146 г НСІ
Жауабы: хлорсутек 90%
146г.
Слайд 145. Массасы 120 г темір (ІІІ) оксидін көміртекпен тотықсыздандырғанда массасы
Слайд 155. Массасы 120 г темір (ІІІ) оксидін көміртекпен тотықсыздандырғанда массасы
Шешуі:
2Ғе2О3 + 3С→ 4Ғе + 3СО2
М(Ғе2О3)= 160 г/моль
m(Ғе2О3) = ν · М(Ғе2О3) = 2 моль · 160 г/моль = 320 г
М(Ғе)= 56 г/моль
m(Ғе) = ν · М(Ғе) = 4 моль · 56 г/моль = 224 г
120 г Ғе2О3 ----- х г Ғе
320 г Ғе2О3 ---- 224 г Ғе
84 г ---- 100 %
67,2 г ---- х %
Жауабы: темірдің шығымы 80%
Слайд 166. 1,7 г аммиак тұз қышқылымен әрекеттескенде 5 г аммоний
Слайд 176. 1,7 г аммиак тұз қышқылымен әрекеттескенде 5 г аммоний
Шешуі:
NН3 + НСІ → NН4СІ
М(NН3)= 17 г/моль
m(NН3) = ν · М(NН3) = 1 моль · 17 г/моль = 17 г
М(NН4СІ) = 53,5 г/моль
m(NН4СІ) = ν · М(NН4СІ) = 1 моль · 53,5 г/моль = 53,5 г
1,7 г NН3----- х г NН4СІ
17 г NН3---- 53,5 г NН4СІ
5,35 г ----- 100 %
5 г ---- х %
Жауабы: NН4СІ 93,4%
Слайд 197. Массасы 1г. сутек газын хлормен синтездеу арқылы 32г. хлорсутек газы
алынды. Теориялық мүмкіндікпен салыстырғандағы өнімнің массалық
үлесін анықтандар. (жауабы: 87,67 пайыз)
8. Теория жүзіндегімен салыстырғандағы шығымы 25,12 пайыз болса,
массасы 3,8г. аммиак алу үшін азот пен сутектің қанша көлемі (қ.ж.)
әрекеттесетінін есептендер. (10л.)
9. Массасы 156г. бензол массасы 193,5г. хлорэтанмен эрекеттескенде
шығымы 80 пайыз болды, түзілген этилбензолдың массасы тең: (169,6г.)
10. Егер теориялық мүмкіндікпен салыстырғандағы шығымы 90 пайыз болса ,
16г. этил спиртінен түзілетін диэтил эфирінің массасы қанша? (11,58г.)
Слайд 2011. Көлемі 44,8л. (қ.ж.) азотты сутекпен әрекеттестіргенде түзілген аммиактың (шығымы50
12. 140г. этилен бромсутекпен эрекеттескенде 500г. бромэтан алынған. Реакция өнімнің шығымы? (91,7п)
13. Техникада глюкозаны, крахмалды гидролиздеу арқылы алады. Егер реакция өнімнің шығымы теориямен салыстырғанда 75 пайыз болатын болса, 81г. крахмалдан алынатын глюкозаның массасы. (67,5г.)
14. Егер шығымы 70 пайыз болса, 500л. ацетиленнен алынатын аминсірке қышқылының массасы? (1,17г.)
15. С3Н8 ------- С3Н6 ------- С3Н7ОН берілген тізбек бойынша, егер өнім шығымы 1сатыда-80 пайыз, 2сатыда-75пайыз болса, 132г. пропаннан алынатын пропанолдың массасы? (108г.)
Слайд 2116. 45г. глюкоза сүт қышқылды ашыған кезінде 40 г. сүт
17. Егер өнімнің шығымы 90 пайыз болса, 153г. 2-метилбутаннан алынытың 2-метилбутадиен-1,3 массасы? (130,05г.)
18. 7,8г. бензол броммен әрекеттескенде 9,7г. бромбензол алынды. Өнімнін шығымы? (61,8п.)
19. Құрамында 30 пайыз крахмалы бар картоптың 1 тоннасынан 100л. этил спирті (тығыздығы-0,88г/мл.) алынса, өнімнін шығымы? (52п.)
20. Лабораторияда 46г. толуолдан 52г. бензой қышқылы алынған болса, өнімнің шығымы? (85,2п.)
21. Әскери уландырғыш затты фосгенді СОСІ2 мына реакция арқылы алады: СО+СІ2 --- СОСІ2. 224мл. Хлормен көмір(ІІ)оксиді әрекеттескенде 200мл. фосген алынды (қ.ж.). Оның шығымы? (89,3п.)
22. Егер шығымы 100пайыз болса, 10г. алюминийді оттекте жаққанда алынған алюминий оксидінің массасы? (18г.)
Слайд 22Үйге тапсырма.
11,2 г темір тұз қышқылымен әрекеттескенде 4,45 л (қ.ж.)
2. 20 кг алюминий оксидінен 10 кг алюминий алынды. Реакция өнімі шығымының массалық үлесін анықтаңыз.
3. 5,64 кг техникалық темір (ІІ) сульфаттын ауада өртегенде, шығымы 75 болған қатты өнімнің (FeO) зат мөлшері (моль)
Слайд 241) Есептің шартың мұқият оқып шығу.
2) Жазып ал: не берілді,
3) Реакция теңдеуің жазып, теңеструге ұмытпа.
4) Реакция теңдеуі бойынша өнімнің теориялық массасың табу.
5) Өнімнің іс жүзіндегі массасың табу.
(кері формула: теор. масса * шығым)
Есептің екінші типің шешу алгоритімі:
Табу керек: өнімнің массасың. (практ.)
Слайд 25 Теория жүзіндегімен салыстырғандағы шығымы 92% болса, онда 23,4г. алюминий
Берілгені: Шешуі:
m (Al(OH)3)= 23,4 г
ηшығ.(Al2O3) = 92%
Табу:
m пр (Al2O3) - ?
1. Есептің шартың мұқият оқы.
2. Жазып ал: не берілді, не табу керек?
Слайд 26
3) Реакция теңдеуің жазып, теңеструге ұмытпа.
Берілгені: Шешуі:
m (Al(OH)3)= 23,4 г
Табу:
m пр (Al2O3) - ?
2Al(OH)3 = Al2O3 +3H2O
Слайд 274. Реакция теңдеуі бойынша өнімнің теориялық массасың табу.
Берілді:
m (Al(OH)3)=
Табу:
m пр (Al2O3) - ?
Шешуі:
2Al(OH)3 = Al2O3 +3H2O
23,4 г
?
2 моль
1 моль
Теңдеу бойынша:
n(Al2O3) = ½ n(Al(OH)3= ½ =
m (Al(OH)3)
M (Al(OH)3)
23,4 г
78 г /моль
= 0,15 моль
mтеор. (Al2O3) = n M = 0,15 моль * 102 г/моль = 15,3 г
Слайд 285) Өнімнің іс жүзіндегі массасың табу.
(кері формула: теор.
Берілді:
m (Al(OH)3)= 23,4 г
ηшығ.(Al2O3) = 92%
Табу:
m пр (Al2O3) - ?
Шешуі:
2Al(OH)3 = Al2O3 +3H2O
23,4 г
?
2 моль
1 моль
Теңдеу бойынша:
n(Al2O3) = ½ n(Al(OH)3= ½ =
m (Al(OH)3)
M (Al(OH)3)
23,4 г
78 г /моль
= 0,15 моль
mтеор. (Al2O3) = n *M = 0,15 моль * 102 г/моль = 15,3 г
m пр.(Al2O3) = 15,3 г. * 0,92 = 14 г
Жауабы: 14 грамм
Слайд 292. Теория жүзіндегімен салыстырғандағы шығымы 92% болса, онда 23,4г. алюминий гидроксидінең
2Al(OH)3 = Al2O3 +3H2O
Слайд 30Есептің үшінші типің шешу алгоритімі:
1) Есептің шартың мұқият оқып шығу.
2) Жазып ал: не берілді, не табу керек?
3) Реакция теңдеуің жазып, теңеструге ұмытпа.
4) Өнімнің теориялық массасын кері формула бойынша есепте. (m пр / ηшығ) .
5) Реакция теңдеуі бойынша реагенттің массасың есептендер.
Табу керек: реагенттің массасың.
Слайд 311. Есептің шартың мұқият оқып шығу.
Теория жүзіндегімен салыстырғандағы шығымы 80%
2. Жазып ал: не берілді, не табу керек?
Берілді:
m пр (Fe) = 11,2 г
ηшығ.(Fe) = 80%
Табу:
m(Fe2O3) - ?
Шешуі:
Слайд 32
3) Реакция теңдеуің жазып, теңеструге ұмытпа.
Берілді:
m пр (Fe) = 11,2
ηшығ. (Fe) = 80%
Табу:
m(Fe2O3) - ?
Шешуі:
Fe2O3 + 3CO = 2Fe + 3CO2
Слайд 334) Өнімнің теориялық массасын кері формула бойынша есепте. (m пр /
Берілгені:
m пр (Fe) = 11,2 г
ηшығ. (Fe) = 80%
Табу:
m(Fe2O3) - ?
Шешуі:
Fe2O3 + 3CO = 2Fe + 3CO2
mтеор = = =14 г
mпр (Fe)
ηшығ. (Fe)
11,2 г
0, 8
Слайд 34 5) Реагенттің массасың есептендер.
Берілгені:
m пр (Fe) = 11,2
ηшығ. (Fe) = 80%
Табу:
m (Fe2O3) - ?
Шешуі:
Fe2O3 + 3CO = 2Fe + 3CO2
mтеор = = =14 г
mпр(Fe)
ηшығ. (Fe)
11,2 г
0, 8
Жауабы: 20 грамм Fe2O3
80%
11,2 г.
х г.
=
100%
=
14 г.
(теор.Fe)
mтеор
=
m (Fe2O3)
=
=
=
14 г.
112 г.
х г.
160 г.
20 г. Fe2O3
Слайд 36n(Fe2O3) = ½ n (Fe) = ½
M (Fe)
m (Fe)
14 г
56 г/моль
m(Fe2O3) = n* M = 0,125 моль* 160 г/моль = 20 г
Слайд 37Сандық есептер №2.
Тақырыбы: Теориялық мүмкіндікпен салыстыра отырып, реакция өніміндегі шығымның массалық
Реакция теңдеуі бойынша теория жүзінде алынуға тиісті өнім массасының іс жүзінде (практикалық) шығатын өнімнің массасына қатынасын өнімнің массалық үлесі (η) эта әрпімен белгілейді:
η=mпр./mтеор.*100% (масса бойынша) (1)
немесе
η =Vпр./Vтеор.*100% (көлем бойынша) (2)
формулалары арқылы есептеледі.
1-мысал. Массасы 1г сутек газын хлормен синтездеу арқылы 32г хлорсутек газы алынды. Теориялық мүмкіндікпен салыстырғандағы өнімнің массалық үлесін (%) анықтаңдар.
Шешуі:
1. Алдымен реакция теңдеуін жазып, теңестіреді, есептің шартында берілген сан мәндерін жазады да, теңдеудегі қажетті заттың астын сызып, ν, M, m белгілейді:
х г теориялық
1г 32 г іс жүзінде
Н2 + Сl2= 2 HCl
ν 1 моль 2 моль
M 2 г/моль 36,5 г/моль
m 2 г 73 г
2. Пропорция құрып, оны шешеміз:
1г/2г=хг/73г, х=36,5 г HCl-тің теориялық шығымы.
3. Енді (2) формула бойынша заттың практикалық шығымы (HCl) 87,67% немесе 0,8767 массалық үлеске сәйкес.
2-мысал. Теория жүзіндегімен салыстырғандағы шығымы 25,12 % болса, массасы 3,8 г аммиак алу үшін азот пен сутектің қанша көлемі (қ.ж.) әрекеттесетінің есептеңдер.
Шешуі:
1. Тік формуланы (1) пайдаланып, аммиактың теориялық шығымы бойынша массасын табамыз.
Егер: 3,8 г NH3 ______25,12% болса,
х г NH3 ______100% болады.
х=3,8г * 100% / 25,12% = 15,13%
2. Реакция теңдеуін жазып теңестіріп, сан мәндерін қоямыз:
х л 15,13 г
N2 + 3H2=2NH3
ν 1 моль 2 моль
Vм 22,4 л/моль 17г/моль
V 22,4 л 34 г
3. Пропорция құрып, азоттың көлемін табамыз:
х/22,4=15,13/34; х= 9,96 л =10 л
Жауабы: V(N2)=10 л