- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химия Кислородные соединения азота (9 класс)
Содержание
- 1. Химия Кислородные соединения азота (9 класс)
- 2. +1 N2O+2 NO+3 N2O3+4
- 3. Оксид азота (I) Закись азота или «веселящий
- 4. Слайд 4
- 5. Слайд 5
- 6. Реагирует с амидами металлов с образованием соответствующих неорганических азидовПри взаимодействии аммиака над катализатором образуется азид аммония
- 7. Слайд 7
- 8. NOФизические свойства: бесцветный газ, термически устойчивый, плохо
- 9. Из свободных элементов соединением азота с кислородом
- 10. Слайд 10
- 11. Окисление кислородом воздухаХарактерны реакции присоединения галогенов с
- 12. Физические свойства: жидкость темно-синего цвета, термически неустойчивая,
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Степень окисления +4NO2Оксид азота(IV)Диоксид азотаФизические свойства: газ,
- 18. Слайд 18
- 19. Слайд 19
- 20. Если растворение проводить в избытке кислорода, образуется
- 21. Слайд 21
- 22. Слайд 22
- 23. N2O5Степень окисления +5Физические свойства: бесцветные, летучие кристаллы.
- 24. Слайд 24
- 25. Слайд 25
- 26. Применяется в лаборатории для получения азотной кислоты
- 27. Слайд 27
Слайд 2+1 N2O
+2 NO
+3 N2O3
+4 NO2, N2O4
+5
По степени окисления:
Азот образует шесть кислородных соединений.
Оксиды азота
Слайд 3Оксид азота (I)
Закись азота или «веселящий газ»
Физические свойства: негорючий
N2O
Степень окисления +1
Слайд 4
Нагреванием сухого нитрата аммония
Нагреванием сульфаминовой кислоты с 73%-й азотной кислотой:
В химической промышленности закись азота является побочным продуктом
Слайд 5
Несолеобразующий
При нагревании проявляет свойства окислителя
При взаимодействии с сильными окислителями проявляет свойства восстановителя
При нагревании разлагается
Слайд 6Реагирует с амидами металлов с образованием соответствующих неорганических азидов
При взаимодействии аммиака
Слайд 8NO
Физические свойства: бесцветный газ, термически устойчивый, плохо растворим в воде, практически
Степень окисления +2
Мон(о)оксид азота, окись азота, нитрозил-радикал
Оксид азота (II)
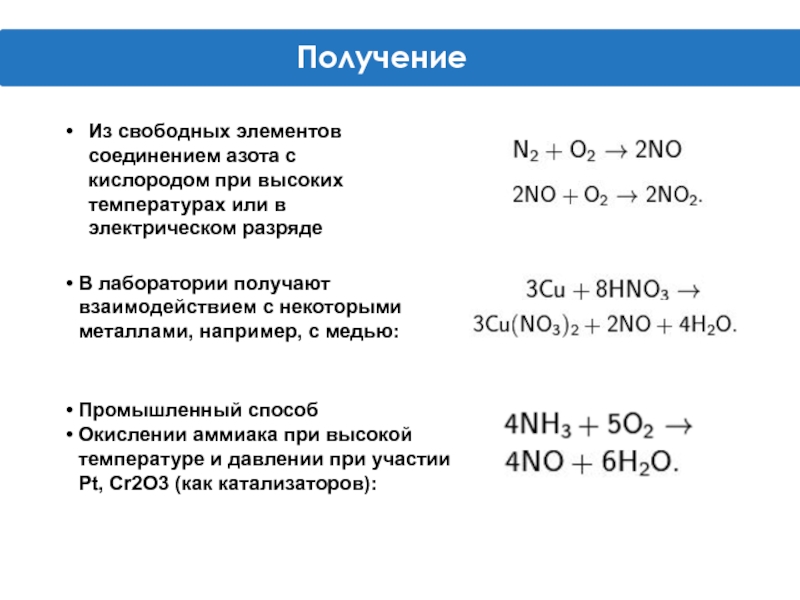
Слайд 9Из свободных элементов соединением азота с кислородом при высоких температурах или
В лаборатории получают взаимодействием с некоторыми металлами, например, с медью:
Промышленный способ
Окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Получение
Слайд 10 Физиологическое действие
Играет важную
в организмах бактерий, грибов и растений, клеток животных.
Его выработка повышена у людей, живущих на больших высотах.
Это способствует приспособлению организма к условиям пониженного парциального давления кислорода.
Окись азота способствует поддержанию гомеостаза сосудов.
Слайд 11Окисление кислородом воздуха
Характерны реакции присоединения галогенов с образованием нитрозилгалогенидов
При более сильных
В воде мало растворим и с ней не реагирует, т.к несолеобразующий
Химические свойства
Слайд 12Физические свойства: жидкость темно-синего цвета, термически неустойчивая, t кип.= 3,5 С
Степень окисления +3
Азотистый ангидрид,
сесквиоксид азота
N2O3
Оксид азота (III)
Слайд 13
50%-я азотная кислота и твёрдый оксид мышьяка(III):
При охлаждении до −36 °С смеси оксидов азота (II) и (IV)
При пропускании электрического разряда через жидкий воздух можно получить порошок голубого цвета:
Слайд 14
Кислотный оксид,подвержен термической диссоциации
Являясь азотистым ангидридом, при взаимодействии с водой даёт азотистую кислоту:
При взаимодействии с растворами щелочей образуются нитриты
Слайд 15 Физиологическое действие
Высокотоксичен. По
Слайд 17Степень окисления +4
NO2
Оксид азота(IV)
Диоксид азота
Физические свойства: газ, красно-бурого цвета, с характерным
Слайд 18
В лаборатории получают воздействием концентрированной азотной кислотой на медь:
Термическим разложением нитрата свинца
Слайд 19
Отличается высокой химической активностью. Взаимодействует с неметаллами
Окислитель
Нитрозный метод получения серной кислоты
При растворении в воде образуются азотная и азотистая кислоты (реакция диспропорционирования)
Слайд 20Если растворение проводить в избытке кислорода, образуется только азотная кислота
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
Слайд 21
Азотистый ангидрит применяется при производстве серной и азотной кислот. Так же диоксид используется в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Слайд 22 Физиологическое действие
Высокотоксичен. Даже
Слайд 23N2O5
Степень окисления +5
Физические свойства: бесцветные, летучие кристаллы. Стабилен при температуре ниже
Оксид азота(V)
Пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид
Слайд 24
Путём дегидратации с помощью P2O5
Пропуская сухой хлор над сухим нитратом серебра
Путём взаимодействия с озоном
Слайд 25
Легко летуч и крайне неустойчив. Разложение происходит со взрывом, без видимых причин
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
Растворяется в щелочах с образованием нитратов: