- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химические свойства кислот
Содержание
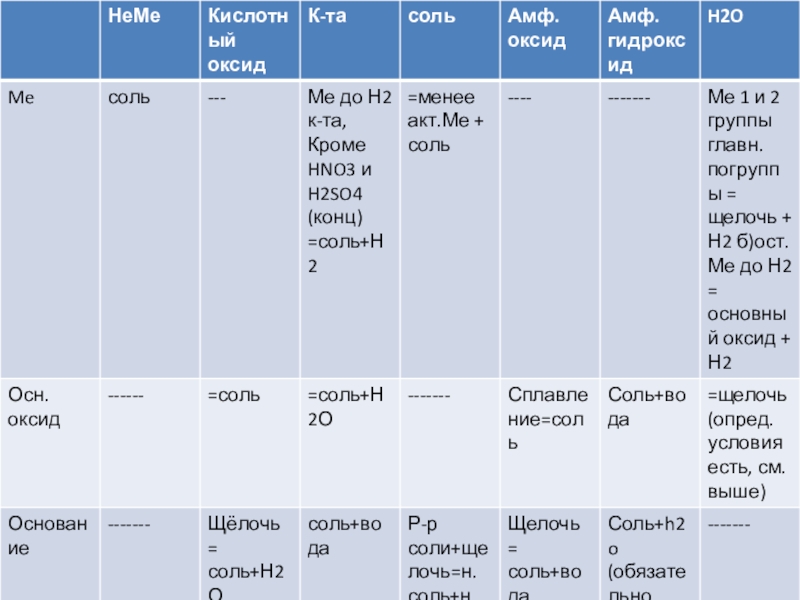
- 1. Химические свойства кислот
- 2. Физические свойства кислот.1.Твёрдые (H3PO4, H3BO3 – борная
- 3. Большинство не имеют запаха, за исключением летучих
- 4. Слайд 4
- 5. Химические свойства1.Изменение окраски Ind
- 6. 2.НейтрализацияКислота + основание = соль + водыЕсли
- 7. 3. Кислота + основный оксид = соль
- 8. 7. к-та + Ме = соль +
- 9. Получение кислотНеметалл (F2,Cl2,Br2,I2,S,Se) + H2 = бескислородная
- 10. Задания в классе
- 11. Слайд 11
- 12. Д.З. 1.Учить всё 2.Сделать задание с фото “кислоты”
- 13. СолиФизические свойстваВ основном все вещества твердого и
- 14. Слайд 14
- 15. Химические свойства средних солей1.Более сильный металл, чем
- 16. 5.Соли разлагаются при нагревание до основного оксида и кислотного оксидаMgC(+4)O3 = MgO + C(+4)O2
- 17. Хим. Св-ва кислых солей1.Ме + кисл. Соль
- 18. 4.кисл. Соль + соли неустойчивых кислот =
- 19. Химические свойства основных солейС Ме не реагируетС
- 20. Слайд 20
- 21. Задания в классе
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Домашние задания: 1.Учить все 2.Сделать задания Соли с фото
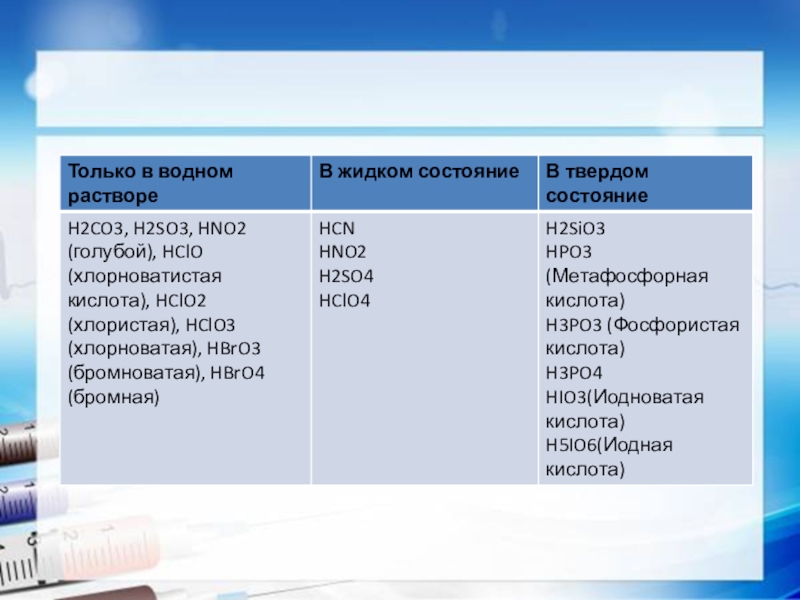
Физические свойства кислот.1.Твёрдые (H3PO4, H3BO3 – борная кислоты, HIO4 – йодная кислота) 2.Жидкие (H2SO4, HNO3)3.Растворы газов (HCl, H2S)Почти все кислоты растворяются в воде, кроме кремниевых кислот.
Слайд 2Физические свойства кислот.
1.Твёрдые (H3PO4, H3BO3 – борная кислоты, HIO4 – йодная
кислота)
2.Жидкие (H2SO4, HNO3)
3.Растворы газов (HCl, H2S)
Почти все кислоты растворяются в воде, кроме кремниевых кислот.
2.Жидкие (H2SO4, HNO3)
3.Растворы газов (HCl, H2S)
Почти все кислоты растворяются в воде, кроме кремниевых кислот.
Слайд 3Большинство не имеют запаха, за исключением летучих кислот:
HCN – запах горького
миндаля
H2S – запах гниющего белка
HCl и HNO3 – резкий запах.
H2S – запах гниющего белка
HCl и HNO3 – резкий запах.
Слайд 62.Нейтрализация
Кислота + основание = соль + воды
Если участвуют многоосновные кислоты или
многокислотные основания, то продуктами могут быть и кислые и основные соли.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
H3PO4 + NaOH = NaH2PO4 + H2O
H3PO4 + 3NaOH = Na3PO4 + 3H2O
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
H3PO4 + NaOH = NaH2PO4 + H2O
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Слайд 73. Кислота + основный оксид = соль + вода
2HNO3 + ZnO
= Zn(NO3)2 + H2O
4.Кислота + ам.оксид (см. ранее)
5.Кислота + амф.гидроксид (см. ранее)
6.Кислота + соль = новая соль + новая кислота
Реакция возможна, при условие образования нерастворимой соли или более слабой кислоты.
HCl + AgNO3 = AgCl + HNO3
4.Кислота + ам.оксид (см. ранее)
5.Кислота + амф.гидроксид (см. ранее)
6.Кислота + соль = новая соль + новая кислота
Реакция возможна, при условие образования нерастворимой соли или более слабой кислоты.
HCl + AgNO3 = AgCl + HNO3
Слайд 87. к-та + Ме = соль + водород
Разб. H2SO4, HCl
и другие кислоты. Все, кроме HNO3 и конц.H2SO4
2Al + 6HCl = 2AlCl3 + 3H2
8. Разложение нестойких кислот при нагревание или на свету.
H2SiO3 = SiO2 + H2O (t)
2HClO = 2HCl + O2 (свет/hv/УФ)
4HNO3 = 4NO2 + O2 + 2H2O (t)
2Al + 6HCl = 2AlCl3 + 3H2
8. Разложение нестойких кислот при нагревание или на свету.
H2SiO3 = SiO2 + H2O (t)
2HClO = 2HCl + O2 (свет/hv/УФ)
4HNO3 = 4NO2 + O2 + 2H2O (t)
Слайд 9Получение кислот
Неметалл (F2,Cl2,Br2,I2,S,Se) + H2 = бескислородная кислота
Кислотный оксид + вода
= оксокислота
S(+6)O3 + H2O = H2S(+6)O4
3. соль+кислота = новая соль + новая кислота
(см.ранее)
S(+6)O3 + H2O = H2S(+6)O4
3. соль+кислота = новая соль + новая кислота
(см.ранее)
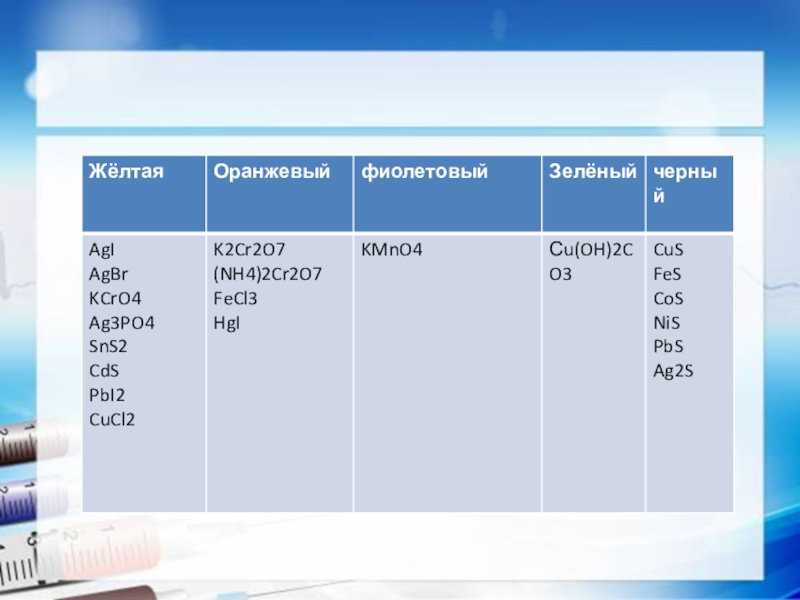
Слайд 13Соли
Физические свойства
В основном все вещества твердого и белого цвета. Некоторые имеют
окраску.
K2Cr2O7 – оранжевый
K2CrO4 – желтый
CoCl3 – розовый
NiSO4- зеленый
CuS- черный
K2Cr2O7 – оранжевый
K2CrO4 – желтый
CoCl3 – розовый
NiSO4- зеленый
CuS- черный
Слайд 15Химические свойства средних солей
1.Более сильный металл, чем металл в соли +
р-р соли = Ме + новая соль
CuSO4 + Fe = FeSO4 + Cu
2. р-р соли + р-р щелочи (см.ранее)
3.Соль + кислота (см.ранее)
4.Соль + соль = новая соль + новая соль.
Обязательно должен быть осадок.
BaCl2+Na2SO4 = 2NaCl + BaSO4
CuSO4 + Fe = FeSO4 + Cu
2. р-р соли + р-р щелочи (см.ранее)
3.Соль + кислота (см.ранее)
4.Соль + соль = новая соль + новая соль.
Обязательно должен быть осадок.
BaCl2+Na2SO4 = 2NaCl + BaSO4
Слайд 165.Соли разлагаются при нагревание до основного оксида и кислотного оксида
MgC(+4)O3 =
MgO + C(+4)O2
Слайд 17Хим. Св-ва кислых солей
1.Ме + кисл. Соль = соль + соль
+ водород
От Аl до H2
2KHSO4 + Fe = K2SO4 + FeSO4 + H2
C акт. Ме
Fe(HSO4)2 + 2Mg = 2MgSO4 + Fe + H2
2.Щелочь + кисл.соль = средняя соль + вода
Ca(HCO3)2+Ca(OH)2 = 2CaCO3 + 2 H2O
3.Кислота + кисл. Соль = средняя соль + кислота
NaHCO3 + HCl = NaCl + H2CO3 (CO2 +H2O)
От Аl до H2
2KHSO4 + Fe = K2SO4 + FeSO4 + H2
C акт. Ме
Fe(HSO4)2 + 2Mg = 2MgSO4 + Fe + H2
2.Щелочь + кисл.соль = средняя соль + вода
Ca(HCO3)2+Ca(OH)2 = 2CaCO3 + 2 H2O
3.Кислота + кисл. Соль = средняя соль + кислота
NaHCO3 + HCl = NaCl + H2CO3 (CO2 +H2O)
Слайд 184.кисл. Соль + соли неустойчивых кислот = соль + соль +
кислота
2KHSO4 + MgCO3 = K2SO4 + MgSO4 + H2CO3 (H2O + CO2)
5.Термическое разложение кислой соли до кислоты и средней соли.
Ca(HCO3)2 = CaCO3 + H2CO3 ( H2O + CO2 ) (t)
2KHSO4 + MgCO3 = K2SO4 + MgSO4 + H2CO3 (H2O + CO2)
5.Термическое разложение кислой соли до кислоты и средней соли.
Ca(HCO3)2 = CaCO3 + H2CO3 ( H2O + CO2 ) (t)
Слайд 19Химические свойства основных солей
С Ме не реагирует
С щелочами = основание +
соль
(CoOH)2SO4 + 2KOH = 2Co(OH)2 + K2SO4
3.С солями не реагирует
4.Термическое разложение до оксида и кислоты
(CuOH)2CO3 = 2CuO + H2CO3 (CO2 + H2O)
(CoOH)2SO4 + 2KOH = 2Co(OH)2 + K2SO4
3.С солями не реагирует
4.Термическое разложение до оксида и кислоты
(CuOH)2CO3 = 2CuO + H2CO3 (CO2 + H2O)