- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химическая связь (7 класс)
Содержание
- 1. Химическая связь (7 класс)
- 2. Давать определение химической связи. 2. Рассматривать классификацию
- 3. Определите валентностьэлементов в следующихвеществах: CaO; Mg3N2; СO2
- 4. «Вопрос о природе химической связи – сердце
- 5. От берега до берегаМожно сделать мост. Соединить два атома В молекулу – вопрос…
- 6. ПроблемаКак атомы соединяются в молекулы?
- 7. Химическая связь-это связь между атомами Химическая связь-
- 8. NB!!!1. Атомы благородных газов имеют 8
- 9. Валентность – это способность атома элемента образовывать
- 10. Электроотрицательность (ЭО)- это способность атомов одного элемента
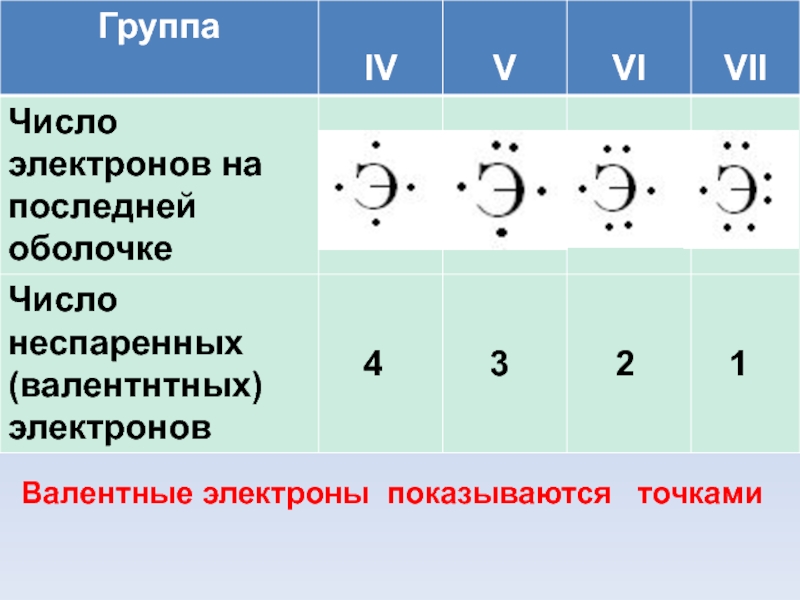
- 11. Валентные электроны показываются точками47651234
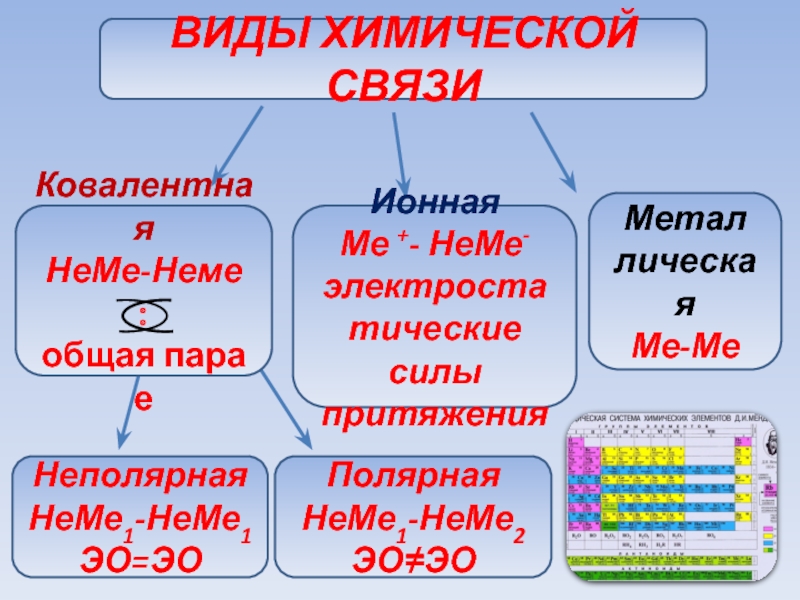
- 12. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИКовалентнаяНеМе-Неме:общая пара еИоннаяМе +- НеМе-электростатические силы притяженияМеталлическаяМе-МеНеполярнаяНеМе1-НеМе1 ЭО=ЭОПолярнаяНеМе1-НеМе2 ЭО≠ЭО
- 13. Слайд 13
- 14. Задание №2. Из перечня веществ выберите формулы с ковалентной неполярной связьюCl2CO2MgH2OO3N2
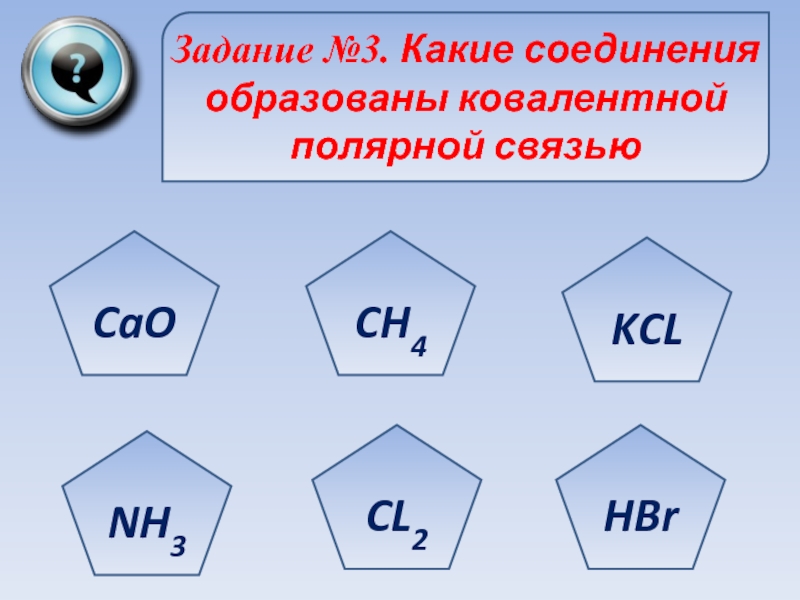
- 15. Задание №3. Какие соединения образованы ковалентной полярной связьюCaONH3CL2HBrKCLCH4
- 16. Задание №4. Выберите группу веществ, в
- 17. Задание №5. Выберите группу веществ, в состав
- 18. Задание №5. Выберите группу веществ, в состав
- 19. Задание №5. Выберите группу веществ, в состав
- 20.
- 21. Рефлексия 1.На уроке я работал… 2.Своей работой
- 22. Разобрать конспект.Повторить параграф: § 3.4-3.6Выполнить задания: Изобразить механизм образования молекул F2; N2*;HF. Домашнее задание
Слайд 2Давать определение химической связи.
2. Рассматривать классификацию ХС.
3. Рассматривать общий механизм
4. Осуществлять рефлексию своей деятельности
В результате изучения темы, вы будете способны:
Слайд 3Определите валентность
элементов в следующих
веществах:
CaO; Mg3N2; СO2 ; HCl; Al2O3;
Al P; Cr O3 ; FeCl2; MgO;
Задание 1.Взаиморефлексия:
II II
III II
III II
IV II
I I
III III
VI II
II I
II II
Слайд 7Химическая связь
-это связь между атомами
Химическая связь
- это силы взаимодействия, которые
Слайд 8 NB!!!
1. Атомы благородных газов имеют 8 электронов на последней оболочке
инертности атомов благородных газов.
2. Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа (8 электронов )и перейти в
наиболее устойчивое состояние.
3.Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.
Слайд 9Валентность – это способность атома
элемента образовывать различное число
химических связей
Величина валентности элемента
определяется числом химических связей, которые атом элемента образует с
другими атомами.
NB!!!
Слайд 10Электроотрицательность (ЭО)- это способность атомов одного элемента
притягивать к себе электроны
Самый электроотрицательный элемент – F.
В образовании химической связи участвуют только валентные электроны.
У Ме главных подгрупп это электроны
последней оболочки.
У НеМе главных подгрупп число
электронов = 8 – № группы
NB!!!
Слайд 12ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
Ковалентная
НеМе-Неме
:
общая пара е
Ионная
Ме +- НеМе-
электростатические силы притяжения
Метал
лическая
Ме-Ме
Неполярная
НеМе1-НеМе1 ЭО=ЭО
Полярная
НеМе1-НеМе2 ЭО≠ЭО
Слайд 14Задание №2. Из перечня веществ выберите формулы с ковалентной неполярной связью
Cl2
CO2
Mg
H2O
O3
N2
Слайд 16Задание №4. Выберите группу веществ, в состав которой входят только
N2 , NH3, KF
CO2, H2O, NaCl
N2, H2, F2
Слайд 17Задание №5. Выберите группу веществ, в состав которой входят только вещества
N2 , NH3, KF
CO2, NH3, НCl
Na, H2, HF,
Слайд 18Задание №5. Выберите группу веществ, в состав которой входят только вещества
CO2, NH3, НCl
N2, H2, F2,
NaCl, CaF2, CaCO3
Слайд 19Задание №5. Выберите группу веществ, в состав которой входят только вещества
N2 , NH3, H2
CO2, NH3, H2O
К, Zn, Fe
Слайд 21Рефлексия
1.На уроке я работал…
2.Своей работой на уроке я…
3.Урок для меня показался…
4.За
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.
Слайд 22
Разобрать конспект.
Повторить параграф: § 3.4-3.6
Выполнить задания:
Изобразить механизм образования молекул
Домашнее задание