- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Содержание
- 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
- 2. Каталог растенийКаталог растений России
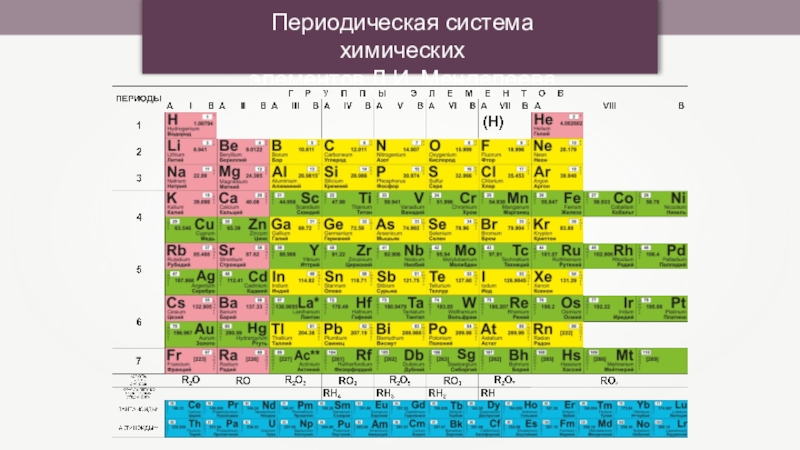
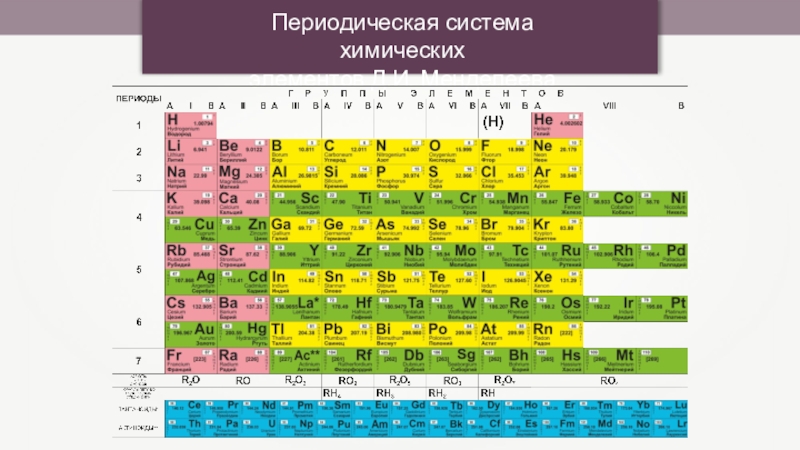
- 3. Периодическая система химических элементов Д.И. Менделеева
- 4. План описания химического элементаНаходим химический элемент в
- 5. Слайд 5
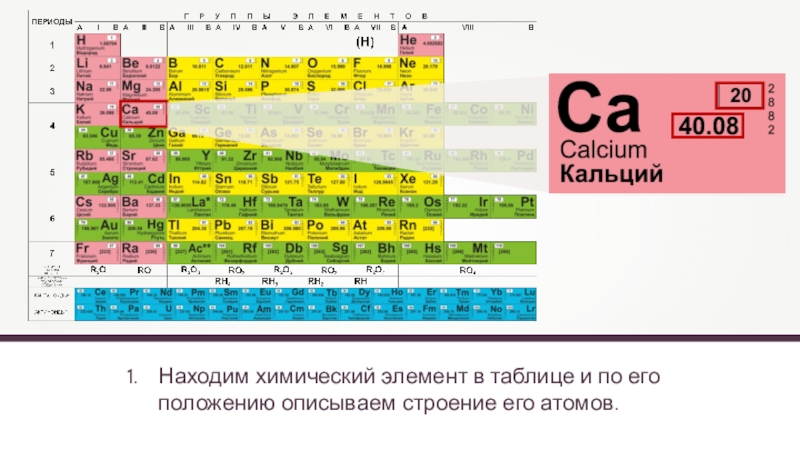
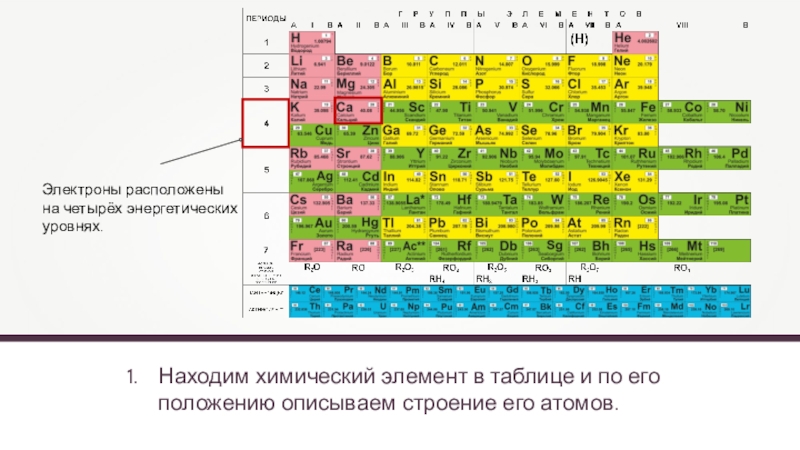
- 6. Находим химический элемент в таблице и по его положению описываем строение его атомов.
- 7. Находим химический элемент в таблице и по
- 8. Находим химический элемент в таблице и по
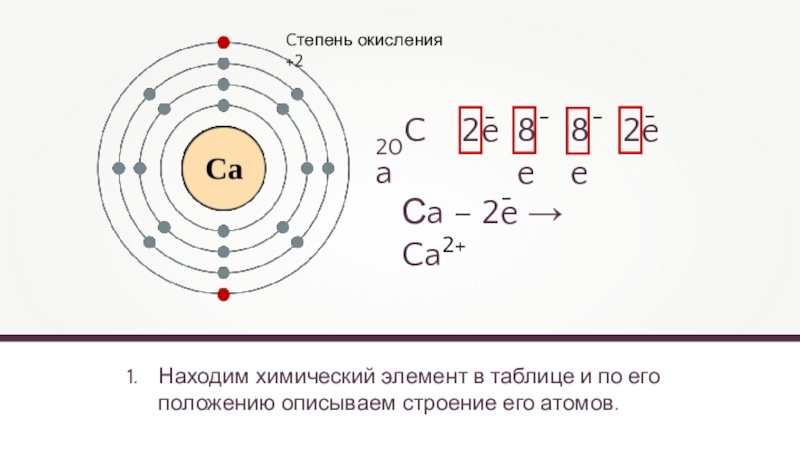
- 9. Находим химический элемент в таблице и по его положению описываем строение его атомов. 20Ca2e8e8e2e––––Cтепень окисления +2
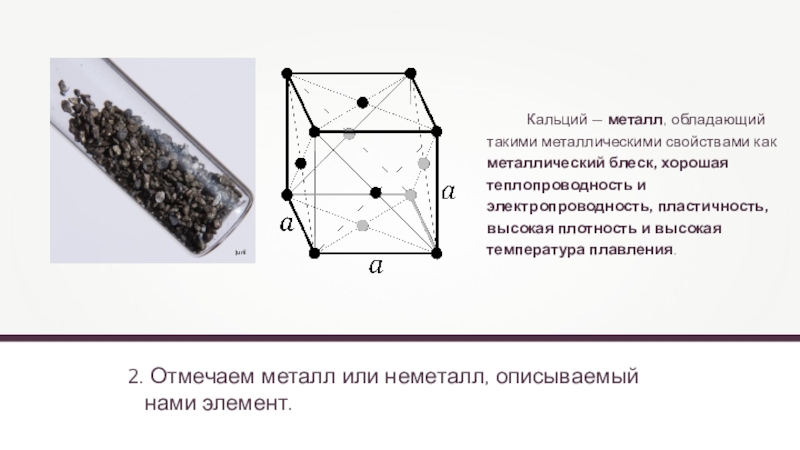
- 10. 2. Отмечаем металл или неметалл, описываемый
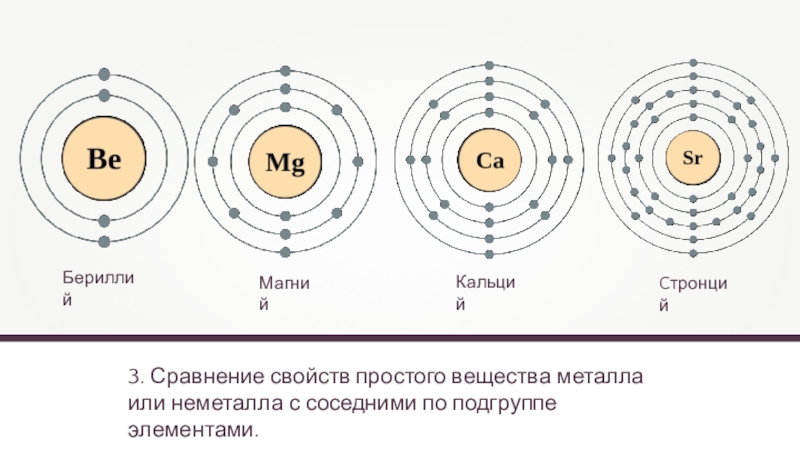
- 11. 3. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами.БериллийКальцийМагнийCтронций
- 12. 4. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.КалийКальций19K20Сa1S2/2S22p6/3S23p6/4S11S2/2S22p6/3S23p6/4S2
- 13. 5. Состав и характеристика высшего оксида описываемого
- 14. 6. Состав и характеристика высшего гидроксида.Гидроксид кальция(Ca(OH)2)Гидроксид
- 15. 7. Состав летучего водородного соединения. Металл кальций (Ca) летучего водородного соединения не образует.
- 16. Находим химический элемент в таблице и по его положению описываем строение его атомов.
- 17. Находим химический элемент в таблице и по
- 18. Находим химический элемент в таблице и по
- 19. 2. Отмечаем металл или неметалл, описываемый
- 20. 3. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами.АзотФосфорМышьяк
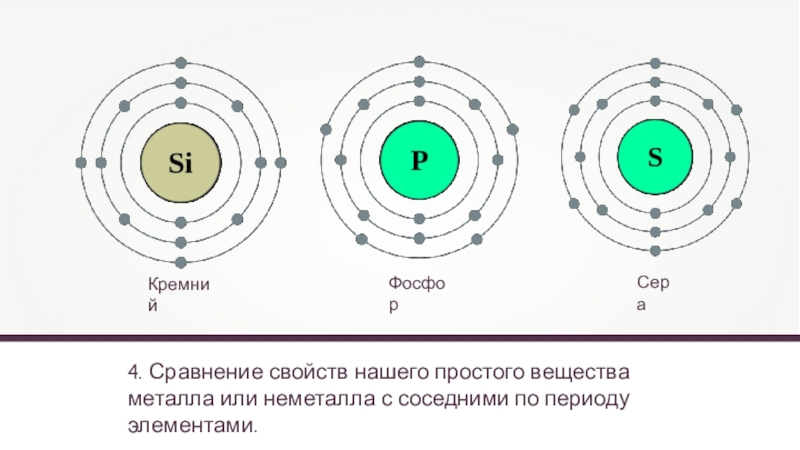
- 21. 4. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.КремнийФосфорСера
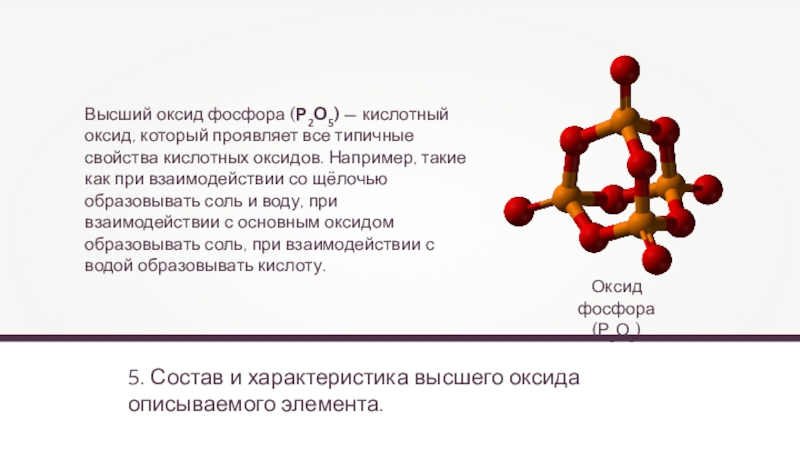
- 22. 5. Состав и характеристика высшего оксида описываемого
- 23. 6. Состав и характеристика высшего гидроксида.Фосфорная кислота(Н3РО4)Высший
- 24. 7. Состав летучего водородного соединения. С водородом фосфор образует летучее соединение фосфин РН3.
- 25. Периодическая система химических элементов Д.И. Менделеева
Слайд 4
План описания химического элемента
Находим химический элемент в таблице и по его
Все химические элементы в таблице делятся на металлы и неметаллы. Отмечаем металл или неметалл, описываемый нами элемент.
Сравнение свойств нашего простого вещества металла или неметалла с соседними по подгруппе элементами.
Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.
Состав и характеристика высшего оксида описываемого элемента (то есть относится к основным, кислотным или амфотерным).
Состав и характеристика высшего гидроксида (то есть он является основанием, амфотерным гидроксидом, кислородосодержащей кислотой).
Если элемент неметалл, то состав летучего водородного соединения.
Слайд 7
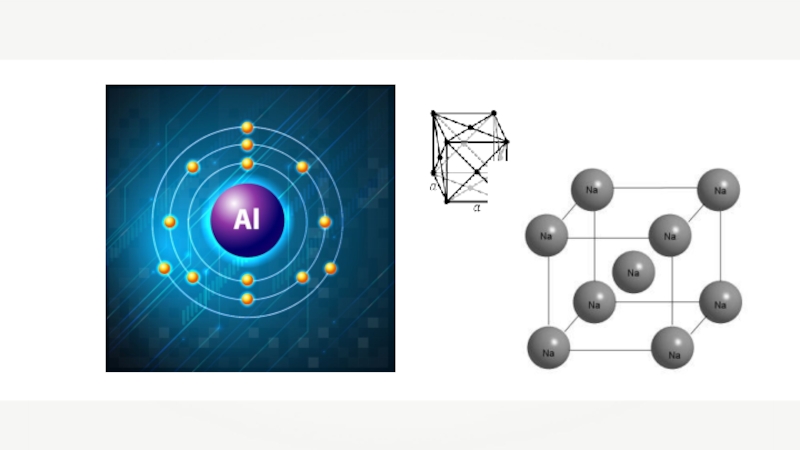
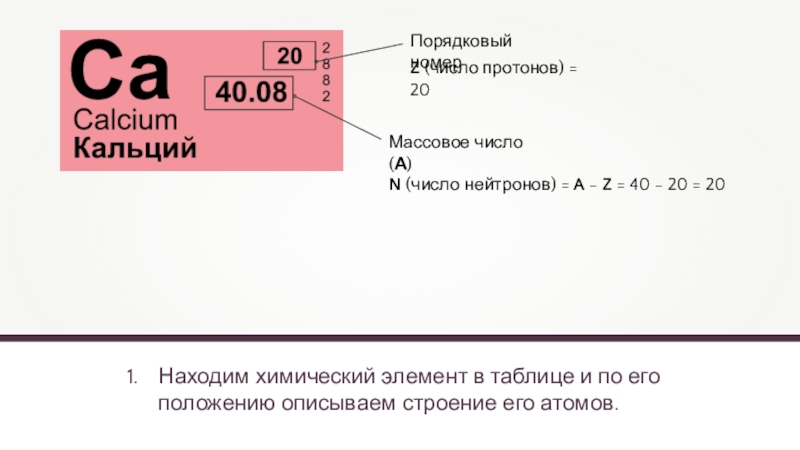
Находим химический элемент в таблице и по его положению описываем строение
Z (число протонов) = 20
N (число нейтронов) = A - Z = 40 - 20 = 20
Слайд 8
Находим химический элемент в таблице и по его положению описываем строение
Электроны расположены
на четырёх энергетических
уровнях.
Слайд 9
Находим химический элемент в таблице и по его положению описываем строение
20Ca
2e
8e
8e
2e
–
–
–
–
Cтепень окисления +2
Слайд 10
2. Отмечаем металл или неметалл, описываемый
нами элемент.
Jurii
Кальций —
Слайд 11
3. Сравнение свойств простого вещества металла или неметалла с соседними по
Бериллий
Кальций
Магний
Cтронций
Слайд 12
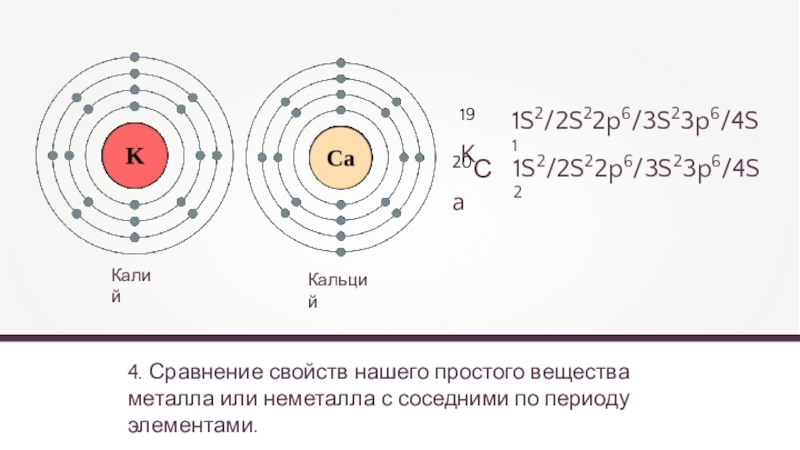
4. Сравнение свойств нашего простого вещества металла или неметалла с соседними
Калий
Кальций
19K
20Сa
1S2/2S22p6/3S23p6/4S1
1S2/2S22p6/3S23p6/4S2
Слайд 13
5. Состав и характеристика высшего оксида описываемого элемента.
Оксид кальция
(СaO)
Оксид кальция СаО
Слайд 14
6. Состав и характеристика высшего гидроксида.
Гидроксид кальция
(Ca(OH)2)
Гидроксид кальция проявляет типичные свойства
Слайд 15
7. Состав летучего водородного соединения.
Металл кальций (Ca) летучего водородного соединения
Слайд 17
Находим химический элемент в таблице и по его положению описываем строение
Z (число протонов) = 15
N (число нейтронов) = A – Z = 31 - 15 = 16
Слайд 18
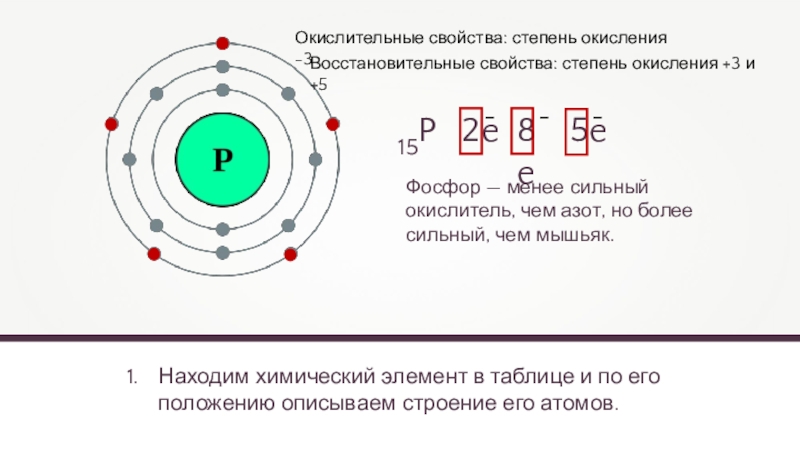
Находим химический элемент в таблице и по его положению описываем строение
15P
2e
8e
5e
–
–
–
Окислительные свойства: степень окисления -3
Фосфор — менее сильный окислитель, чем азот, но более сильный, чем мышьяк.
Восстановительные свойства: степень окисления +3 и +5
Слайд 19
2. Отмечаем металл или неметалл, описываемый
нами элемент.
Materialscientist
Фосфор относится
к типичным неметаллам.
Кристаллическая структура
чёрного фосфора
Кристаллическая структура
красного фосфора
Слайд 20
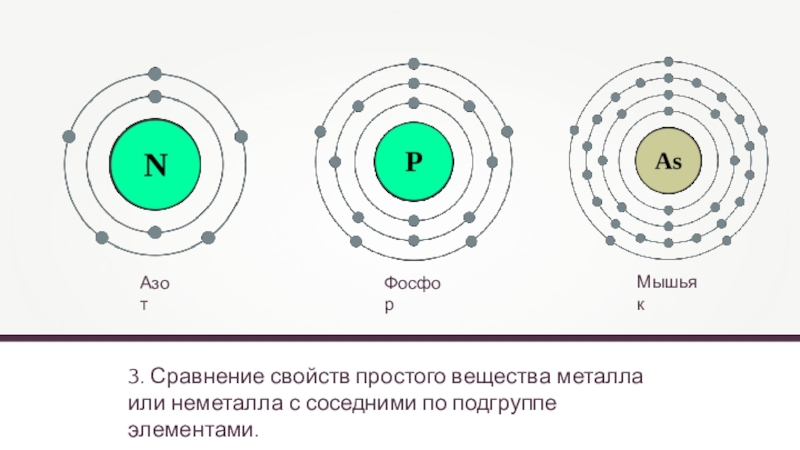
3. Сравнение свойств простого вещества металла или неметалла с соседними по
Азот
Фосфор
Мышьяк
Слайд 21
4. Сравнение свойств нашего простого вещества металла или неметалла с соседними
Кремний
Фосфор
Сера