- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Характеристика элемента-металла по положению в ПСХЭ им. Д.И, Менделеева
Содержание
- 1. Характеристика элемента-металла по положению в ПСХЭ им. Д.И, Менделеева
- 2. На примере натрия.Число протонов р+= номеру элемента
- 3. 5. Число электронов на внешнем уровне= номер
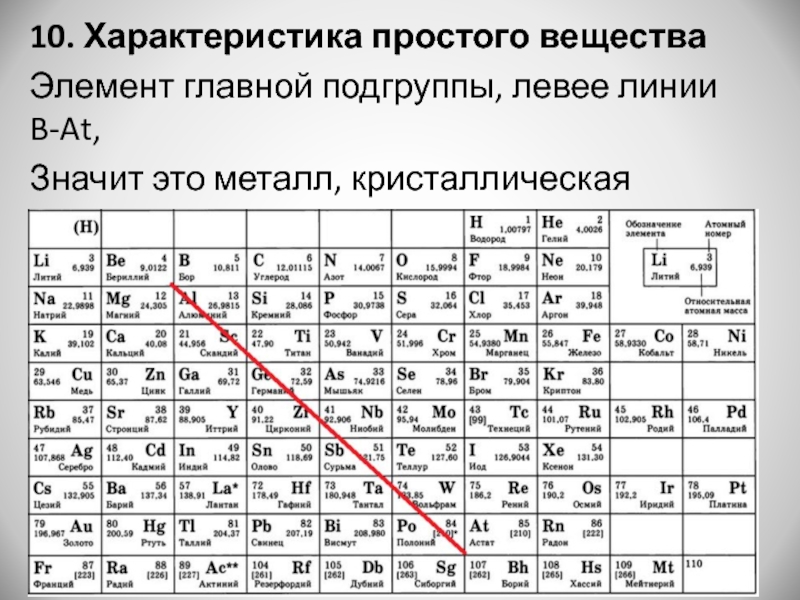
- 4. 10. Характеристика простого веществаЭлемент главной подгруппы, левее линии B-At,Значит это металл, кристаллическая решетка - металлическая
- 5. Окислительно-восстановительные свойства простого вещества:Проявляет только восстановительные свойства,
- 6. Кислотно-основные свойства оксидов:
- 7. По таблице понятно, что оксид натрия –
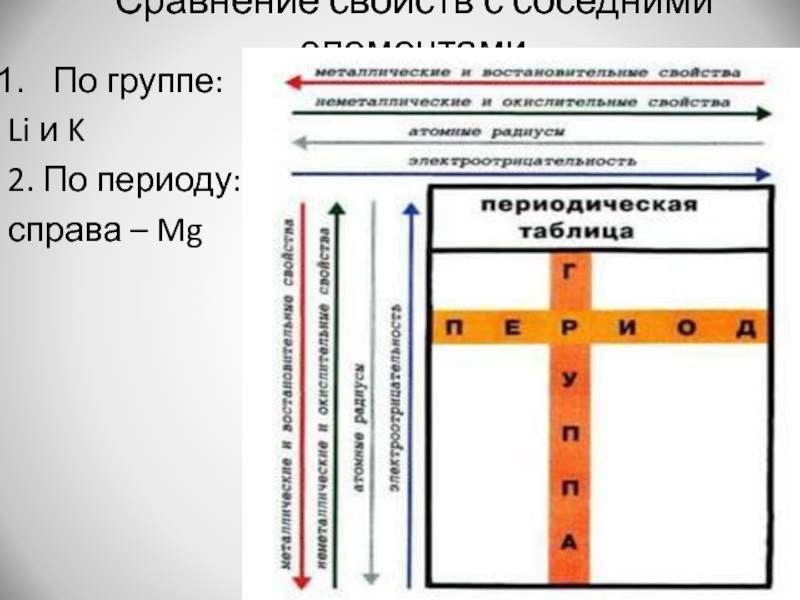
- 8. Сравнение свойств с соседними элементамиПо группе: Li и K2. По периоду: справа – Mg
- 9. Что можно сказать?Металлические свойства натрия выше, чем
- 10. Слайд 10
- 11. Сравнение свойства оксидов/гидроксидов
- 12. Свойства оксидов/гидроксидовКислотность растет направо и наверх.Основность растет
- 13. Теперь самостоятельно рассмотрим магний по тому же
- 14. 10. Характеристика простого вещества11. Характеристика высшего оксиды12. Характеристика высшего гидроксида13. Характеристика летучего водородного соединения (для неметаллов)
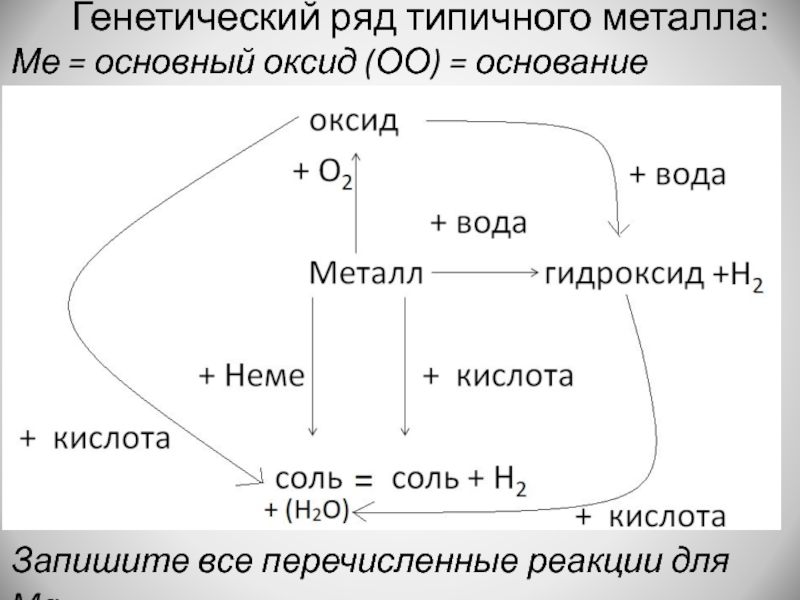
- 15. Генетический ряд типичного металла:Ме = основный оксид (ОО) = основаниеЗапишите все перечисленные реакции для Mg.
- 16. Домашнее заданиеУчить материал конспекта§ 1, после него
На примере натрия.Число протонов р+= номеру элемента = заряду ядра = 112. Число электронов е-= числу протонов = 113. Число нейтронов n0= масса – заряд ядра= 23 – 11 = 124. Число энергетических уровней= номеру периода
Слайд 2На примере натрия.
Число протонов р+
= номеру элемента = заряду ядра =
11
2. Число электронов е-
= числу протонов = 11
3. Число нейтронов n0
= масса – заряд ядра= 23 – 11 = 12
4. Число энергетических уровней
= номеру периода = 3, малый период
2. Число электронов е-
= числу протонов = 11
3. Число нейтронов n0
= масса – заряд ядра= 23 – 11 = 12
4. Число энергетических уровней
= номеру периода = 3, малый период
Слайд 35. Число электронов на внешнем уровне
= номер группы = 1, уровень
далек от завершения
6. Распределение электронов по уровням
максимум по уровням 2, 8, 18
7. Распределение электронов по орбиталям
1s2 2s22p6 3s1
8. Максимальная степень окисления
= номеру группы = 1
9. Минимальная степень окисления
= для металлов = 0
6. Распределение электронов по уровням
максимум по уровням 2, 8, 18
7. Распределение электронов по орбиталям
1s2 2s22p6 3s1
8. Максимальная степень окисления
= номеру группы = 1
9. Минимальная степень окисления
= для металлов = 0
Слайд 410. Характеристика простого вещества
Элемент главной подгруппы, левее линии B-At,
Значит это металл,
кристаллическая решетка - металлическая
Слайд 5Окислительно-восстановительные свойства простого вещества:
Проявляет только восстановительные свойства, отдает 1 электрон: Na0
– 1e- = Na+
11. Характеристика высшего оксида (что это?)
Оксид – бинарное (состоящее из 2ух типов атомов) соединение, содержащее кислород в С.О. -2.
Высший оксид – оксид, в котором элемент проявляет высшую (максимальную) С.О.
Na+O-2 – расставим индексы (СНИЗУ СПРАВА) накрест
Na2O
11. Характеристика высшего оксида (что это?)
Оксид – бинарное (состоящее из 2ух типов атомов) соединение, содержащее кислород в С.О. -2.
Высший оксид – оксид, в котором элемент проявляет высшую (максимальную) С.О.
Na+O-2 – расставим индексы (СНИЗУ СПРАВА) накрест
Na2O
Слайд 7По таблице понятно, что оксид натрия – основный.
12. Характеристика высшего гидроксида
Гидроксид
– соединение катиона с ОН группой.
Щелочи – растворимые гидроксиды металлов. Гидроксид натрия NaOH – это щелочь, сильное основание.
Щелочи – растворимые гидроксиды металлов. Гидроксид натрия NaOH – это щелочь, сильное основание.
Слайд 9Что можно сказать?
Металлические свойства натрия выше, чем у лития и магния;
и ниже, чем у калия.
Неметаллические свойства натрия выше, чем у калия; и ниже, чем у лития и магния.
ОЭО натрия выше, чем у калия; и ниже, чем у лития и магния.
Радиус атома натрия больше, чем у лития и магния; и ниже, чем у калия.
Неметаллические свойства натрия выше, чем у калия; и ниже, чем у лития и магния.
ОЭО натрия выше, чем у калия; и ниже, чем у лития и магния.
Радиус атома натрия больше, чем у лития и магния; и ниже, чем у калия.
Слайд 12Свойства оксидов/гидроксидов
Кислотность растет направо и наверх.
Основность растет направо и вниз.
Таким образом,
оксид и гидроксид натрия более кислотны, чем у калия; и менее – чем у магния и лития.
Оксид и гидроксид натрия более основны, чем у магния и лития; и менее – чем у калия.
Оксид и гидроксид натрия более основны, чем у магния и лития; и менее – чем у калия.
Слайд 13Теперь самостоятельно рассмотрим магний по тому же плану
Число протонов р+
2.
Число электронов е-
3. Число нейтронов n0
4. Число энергетических уровней
5. Число электронов на внешнем уровне
6. Распределение электронов по уровням
7. Распределение электронов по орбиталям
8. Максимальная степень окисления
9. Минимальная степень окисления
3. Число нейтронов n0
4. Число энергетических уровней
5. Число электронов на внешнем уровне
6. Распределение электронов по уровням
7. Распределение электронов по орбиталям
8. Максимальная степень окисления
9. Минимальная степень окисления
Слайд 1410. Характеристика простого вещества
11. Характеристика высшего оксиды
12. Характеристика высшего гидроксида
13. Характеристика
летучего водородного соединения (для неметаллов)
Слайд 15Генетический ряд типичного металла:
Ме = основный оксид (ОО) = основание
Запишите все
перечисленные реакции для Mg.
Слайд 16Домашнее задание
Учить материал конспекта
§ 1, после него вопрос 3
Осуществить цепочки превращений:
Na
= Na2O = NaOH = NaCl
Ba = BaO = Ba(OH)2 = BaSO4
Ba = BaO = Ba(OH)2 = BaSO4