- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Гидролиз неорганических веществ
Содержание
- 1. Гидролиз неорганических веществ
- 2. Задача:При сливании раствора, содержащего 5 моль хлорида
- 3. Гидролиз – это реакция обменного взаимодействия вещества с водой, приводящая к их разложению.Необратимый ОбратимыйГидролиз
- 4. Соль – продукт взаимодействия кислоты и основания.
- 5. В процессе гидролиза в водном растворе появляется
- 6. 2. Соли, образованные катионом слабого основания
- 7. 3.Соли, образованные катионом слабого основания и анионом
- 8. 4.Соли, образованные катионом сильного основания и анионом
- 9. Al2S3 + 6H2O = 2Al(OH)3 + 3H2Sслаб.основ-е
- 10. Слайд 10
- 11. Получение гидролизного спирта:(С6Н10О5)n + nН2О
- 12. Получение мыла:Жиры + вода
- 13. №1. Верны ли утверждения?
- 14. №2.Установите соответствие между формулой соли и отношением
- 15. №3. Установите соответствие между солью и окраской
- 16. Домашнее задание:§16, упражнение №1 и2 устно
- 17. Спасибо за урок!
Слайд 1
«Гидролиз
Подготовила учитель химии Ильясова Б.Н.
МКОУ «Герменчикская СОШ»
Слайд 2Задача:
При сливании раствора, содержащего 5 моль хлорида железа (III), с избытком
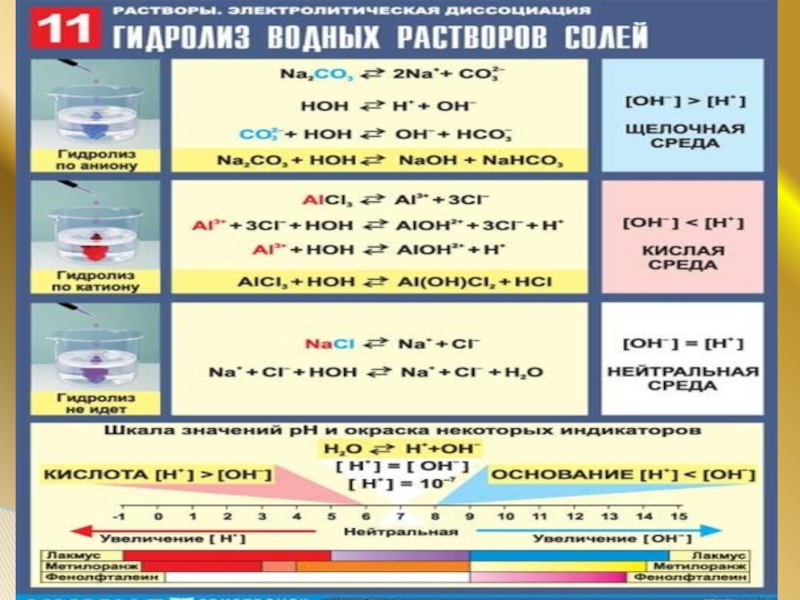
Слайд 3Гидролиз – это реакция обменного взаимодействия вещества с водой, приводящая к
Необратимый
Обратимый
Гидролиз
Слайд 5В процессе гидролиза в водном растворе появляется избыток катионов Н+ или
1. Соли, образованные катионом сильного основания и анионом слабой кислоты, подвергаются гидролизу по аниону , среда раствора щелочная:
Na2S ↔ 2Na+ +S-2
S-2 + Н+ОН–↔ Н+ S-2 + ОН–
Слайд 62. Соли, образованные катионом слабого основания и анионом сильной кислоты,
FeCl2 ↔Fe+2 +2Cl-
Fe+2 +Н+ОН–↔(FeOH)++ Н+
Слайд 73.Соли, образованные катионом слабого основания и анионом слабой кислоты, подвергаются гидролизу
ZnCO3 ↔Zn2+ +CO32-
Zn+2 + Н+ОН–↔ (Zn OH)+ + Н+
CO32- +Н+ОН– ↔Н+CO3- +ОН–
Слайд 8
4.Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются
Слайд 9Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
слаб.основ-е слаб.к-та
Al(OH)3
CaC2 + 2H2O = Ca(OH)2 + C2H2
ацетилен
– Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа.
Необратимый гидролиз
Слайд 11Получение гидролизного спирта:
(С6Н10О5)n + nН2О
ЦЕЛЛЮЛОЗА
(опилки, щепа)
С6Н12О6 2С2Н5ОН + 2 СО2
этанол
Гидролиз органических соединений и его практическое значение
ферменты
Слайд 12
Получение мыла:
Жиры + вода
(низкого качества)
Обменные процессы в организме:
АТФ + вода АДФ + Н3РО4 + 40 кДж
Гидролиз органических соединений и его практическое значение
сода
Слайд 13 №1. Верны ли утверждения?
1.В чистой воде рН=7.
2.Раствор
3.Соль Na2CO3 образована сильным основанием и слабой кислотой.
4.Соль AlCl3 образована слабым основанием и сильной кислотой.
Слайд 14№2.Установите соответствие между формулой соли и отношением ее к гидролизу.
ФОРМУЛА СОЛИ
А) NaNO3 1) гидролизуется по катиону
Б) HgF2 2) гидролизуется по аниону
В) Fe(NO3)3 3) гидролизуется по катиону и аниону
Г) Ca(CH3COO)2 4) не гидролизуется
Слайд 15№3. Установите соответствие между солью и окраской лакмуса в ее растворе.
СОЛЬ ОКРАСКА ЛАКМУСА
А) NH4NO3 1) синяя
Б) K2SO4 2) красная
В) CaCO3 3) фиолетовая
Г) BaBr2