- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Гидролиз для 11 класса
Содержание
- 1. Гидролиз для 11 класса
- 2. Гидролиз – процесс обменного взаимодействия сложных веществ
- 3. Роль воды в химических реакциях
- 4. Слайд 4
- 5. Вода- реагент
- 6. Виды гидролиза1.Гидролиз солеподобных веществCa3P2 + 6 H+-OH- → 3 Ca(OH)2↓+2 PH3↑CaC2 + 2 H+OH-→Ca(OH)2↓+C2H2↑
- 7. Гидролиз бинарных соединений неметаллов P+3Cl5-1 + 4
- 8. Гидролиз солей
- 9. Гидролизу не подвергаютсяСоли, нерастворимые в H2OСоли растворимые,
- 10. Гидролизу подвергаютсяСоли растворимые, в составе которых есть
- 11. Алгоритм составления уравнений гидролиза.Записать уравнение диссоциации соли.Выбрать
- 12. Особые случаи гидролиза BiCl3 + 2H2O → Bi(OH)2Cl↓ + 2HClSbCl3 + H2O → SbOCl↓+ 2HCl2Na2CO3+ 2CuSO4+H2O→→(CuOH)2CO3↓+2Na2SO4+CO2↑
- 13. Домашнее задание§ 18, конспект по прочитанному материалу.Выполнить
Гидролиз – процесс обменного взаимодействия сложных веществ с водойСложные вещества:Бинарные МеN, MeP, MeSi, MeCСоли – MeR, MeHR, MeOHRПри гидролизе, как правило, степень окисления сохраняется это не ОВР.
Слайд 2Гидролиз – процесс обменного взаимодействия сложных веществ с водой
Сложные вещества:
Бинарные МеN,
MeP, MeSi, MeC
Соли – MeR, MeHR, MeOHR
При гидролизе, как правило, степень окисления сохраняется это не ОВР.
Соли – MeR, MeHR, MeOHR
При гидролизе, как правило, степень окисления сохраняется это не ОВР.
Слайд 6Виды гидролиза
1.Гидролиз солеподобных веществ
Ca3P2 + 6 H+-OH- → 3 Ca(OH)2↓+2 PH3↑
CaC2
+ 2 H+OH-→Ca(OH)2↓+C2H2↑
Слайд 7Гидролиз бинарных соединений неметаллов
P+3Cl5-1 + 4 H-OH → 5
H+Cl-1 +H3P+3O4
SiCl4 + 3 H-OH → 4 HCl + H2SiO3↓
SiCl4 + 3 H-OH → 4 HCl + H2SiO3↓
Слайд 9Гидролизу не подвергаются
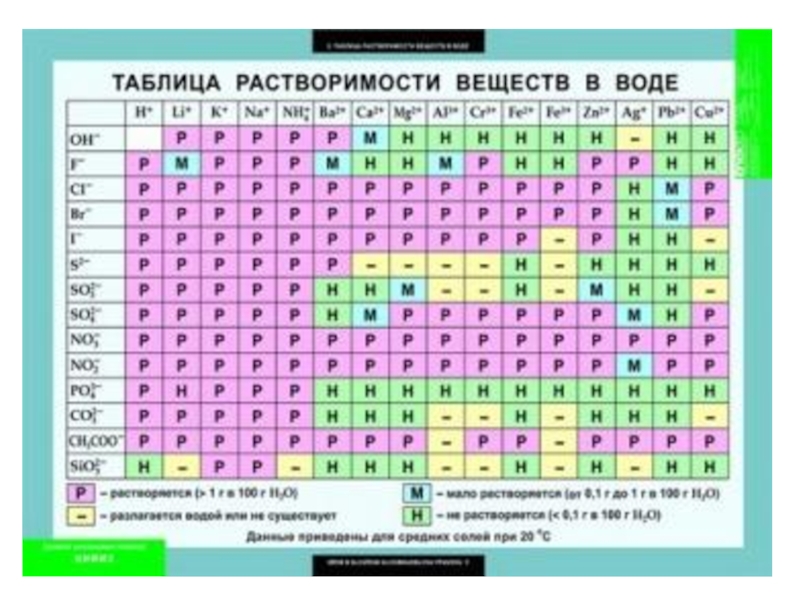
Соли, нерастворимые в H2O
Соли растворимые, но образованные сильной кислотой
и сильным основанием: NaCl, K2SO4, LiNO3, BaBr2, CaI2 и т.д.
Слайд 10Гидролизу подвергаются
Соли растворимые, в составе которых есть хотя бы один слабый
ион ( Na2CO3, CuSO4, NH4F) .Это обратимый гидролиз.
Cоли, напротив которых в таблице растворимости стоит прочерк, необратимо гидролизуются.
Al2S3 + 6 H2O → 2Al(OH)3↓ + 3H2S↑
Cоли, напротив которых в таблице растворимости стоит прочерк, необратимо гидролизуются.
Al2S3 + 6 H2O → 2Al(OH)3↓ + 3H2S↑
Слайд 11Алгоритм составления уравнений гидролиза.
Записать уравнение диссоциации соли.
Выбрать слабый ион.
Записать его взаимодействие
с водой.
Определить среду раствора изменение окраски фенолфталеина.
Определить среду раствора изменение окраски фенолфталеина.
Слайд 12Особые случаи гидролиза
BiCl3 + 2H2O → Bi(OH)2Cl↓ + 2HCl
SbCl3 +
H2O → SbOCl↓+ 2HCl
2Na2CO3+ 2CuSO4+H2O→
→(CuOH)2CO3↓+2Na2SO4+CO2↑
2Na2CO3+ 2CuSO4+H2O→
→(CuOH)2CO3↓+2Na2SO4+CO2↑
Слайд 13Домашнее задание
§ 18, конспект по прочитанному материалу.
Выполнить презентацию по теме: «Использование
реакции гидролиза для получения органических соединений»