Родниковка орта мектебі химия пәні мұғалімі Боқырова А.Б.
Галогендерге жалпы сипаттама 10 класс
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Галогендерге жалпы сипаттама 10 класс презентация химия
Содержание
- 1. Галогендерге жалпы сипаттама 10 класс презентация химия
- 2. Сабақтың мақсаты: П.ж.негізінде галогендердісалыстыра отырып,оқушылардыңбілімін тереңдету.Ұқыптылыққа,жауапкершілікке,табиғат байлықтарынқорғай білуге тәрбиелеу.Галогендердің қолданылуын,маңызын ашуға,тәжірибе жасаудағдыларын дамыту.
- 3. Сабақтың жоспары: 1.Ұйымдастыру формасы.2.Қайталау-оқу анасы.3.Релаксация.(мағынаны ашу)4.”Білгенге-маржан”.5.”Сен оқысаң-мен тоқығам”.6.Ізденген жетер мұратқа.7.Қорытындылау,бағалау.8.Үйге тапсырма.
- 4. Қайталау –оқу анасы. Үй тапсырмасын сұрау:
- 5. Релаксация Мағынаны тану:(анаграмма)ГАЛОГЕНДЕР
- 6. «Білгенге-маржан»
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Физикалық қасиеті: Сары жасыл балқу темп.-219,7C қайн,.темп.188,2 бүлдіргіш Фтор Ғ газ
- 11. Слайд 11
- 12. Қолданылуы ФторФторопласталудамедицинадаТоңазытқыш заттарӨсімдік зиянкес.өлтіретін зат алуда.
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Алу жолдары: Лабороторияда: Өнеркәсіпте: 1.Зертханада концентірлі тұз
- 17. Слайд 17
- 18. Слайд 18
- 19. Қолданылуы ХлорТұз қышқылыналудаБояулар әзірлеуМатаны ағартудаЕріткіштерХлорлы әктехникададәрі-дәрмекПластмасса
- 20. Слайд 20
- 21. Слайд 21
- 22. Физикалық қасиеттері: Бром Вr Қара-сұр Қызыл-
- 23. Слайд 23
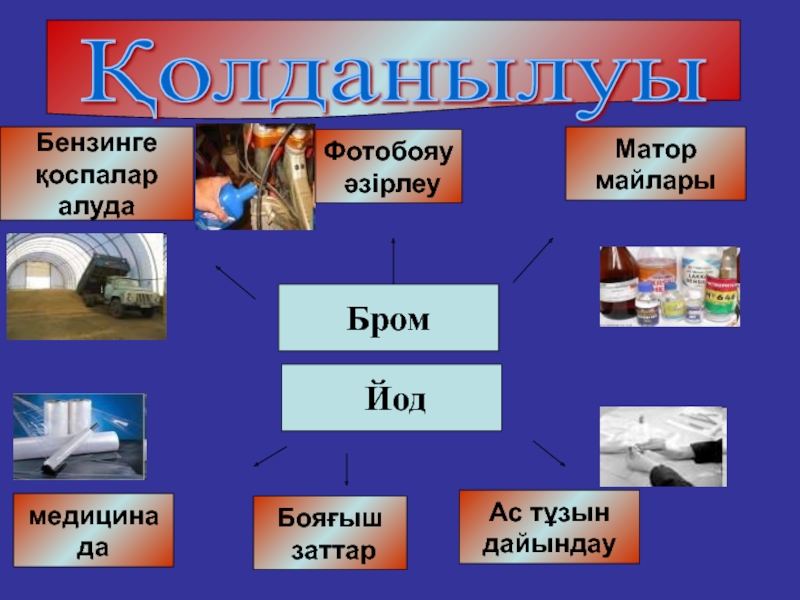
- 24. Қолданылуы БромБензинге қоспалар алудаФотобояу әзірлеуАс тұзындайындауМатор майларымедицинадаБояғыш заттар Йод
- 25. Слайд 25
- 26. «Сен оқысаң-мен тоқығам».(бұл бөлімде оқушылар жаңа
- 27. «Ізденген жетер мұратқа»Есептер шығару.1-тапсырма:Айналуларды іске асыруға
- 28. Қорытындылау: 1-тапсырма:INSERT тесті.(сәйкесін табыңыз).
- 29. 2-тапсырма:
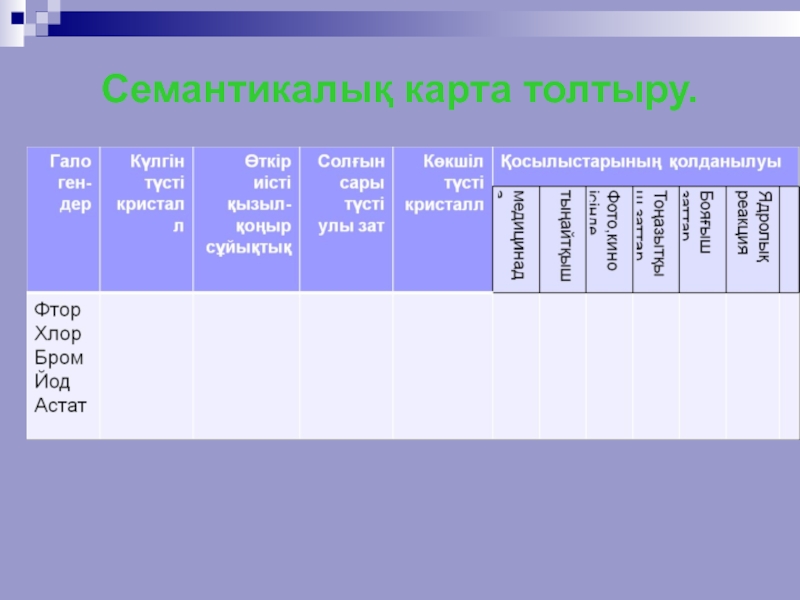
- 30. Семантикалық карта толтыру.
- 31. Галогендердің тотықтырғыштық қасиеті топ бойынша қалай
- 32. Бағалау Үйге тапсырма: §6.17-6.18 Галогендер және
Слайд 1
Слайд 2
Сабақтың мақсаты:
П.ж.негізінде галогендерді
салыстыра отырып,
оқушылардың
білімін тереңдету.
Ұқыптылыққа,жауапкершілікке,
табиғат байлықтарын
қорғай білуге
тәрбиелеу.
Галогендердің қолданылуын,
маңызын
тәжірибе жасау
дағдыларын дамыту.
Слайд 3
Сабақтың жоспары:
1.Ұйымдастыру формасы.
2.Қайталау-оқу анасы.
3.Релаксация.(мағынаны ашу)
4.”Білгенге-маржан”.
5.”Сен оқысаң-мен тоқығам”.
6.Ізденген жетер мұратқа.
7.Қорытындылау,бағалау.
8.Үйге
Слайд 4
Қайталау –оқу анасы. Үй тапсырмасын сұрау:
Өткен тақырыпты пысықтау сұрақтары:
1.Күкірттің
2.Құрамында күкірті бар минералдарды білесіз бе?Қайда кездеседі?
3.Күкірт және оның қосылыстарының қолданылуы?
Слайд 7
Атом құрылысы.
Фтор периодтық жүйенің II периодында VII топтың негізгі топшасында (VIIA) орналасқан. Ядросында 9 протон, 10 нейтрон бар, ядроны екі электрондық қабатта 9 электрон айналады. Фтор атомының электрондық формуласы ls22s22p5, валенттілік электрондары 2s22p5, олардың электронды -графикалық формуласы: Фтор атомының 2р-деңгейшесінде бір дара электроны болғандықтан ол қосылыстарында I валенттілік көрсетеді, ал тотығу дәрежелері — 1,0. Ол ең күшті тотықтырғыш, себебі оның электртерістілігінің мәні ең жоғары (4), сондықтан ол тек бір электронды өзіне оңай қосады:
Ғ0 + е --> Ғ-
Молекула құрылысы.
Фтор молекуласы екі атомнан тұрады Ғ2, атомдар арасында полюссіз ковалентті о-байланысы болады, оның түзілу табиғаты хлор молекуласындағыдай.
Слайд 8
Табиғатта таралуы.
Табиғатта фтор тұздар күйінде кездеседі.
СаF2 - флюорит, балқытқыш шпат,
3NaF • AlF3 - криолит,
ЗСа3(РO4)2-СаF2 - фторапатит.
Адамдар мен жануарлардың сүйектерінің және тіс кіреукесінің құрамында да фтор бар.
Слайд 11
Химиялық қасиеттері.
Фтор бос күйінде өте белсенді бейметалл, инертті газдардың ішінде гелий, неон, аргоннан басқа заттардың барлығымен әрекеттеседі. Электртерістілігі жоғары элементтердің бірі оттек (3,5) фтормен қосылысында оң тотығу дәрежесін көрсетеді. 0+2F2 (оттектің фториді).
Кейбір жай заттармен әрекеттесуінің реакция теңдеулерін келтірейік:
F2 + Н2 = 2НF фторлы сутек
Фтор сутегімен тіпті караңғыда да шабытты әрекеттеседі. Металдармен әрекеттесіп фторидтер түзеді.
Ғ2 + 2Li= 2LiF литий фториді
Ғ2 + Cu = CuF2 мыс (II) фториді
Бұл реакциялар осы заттардың (Li, Cu) оттегімен және хлормен жүретін реакцияларына қарағанда шабыттырақ өтеді.
Слайд 12
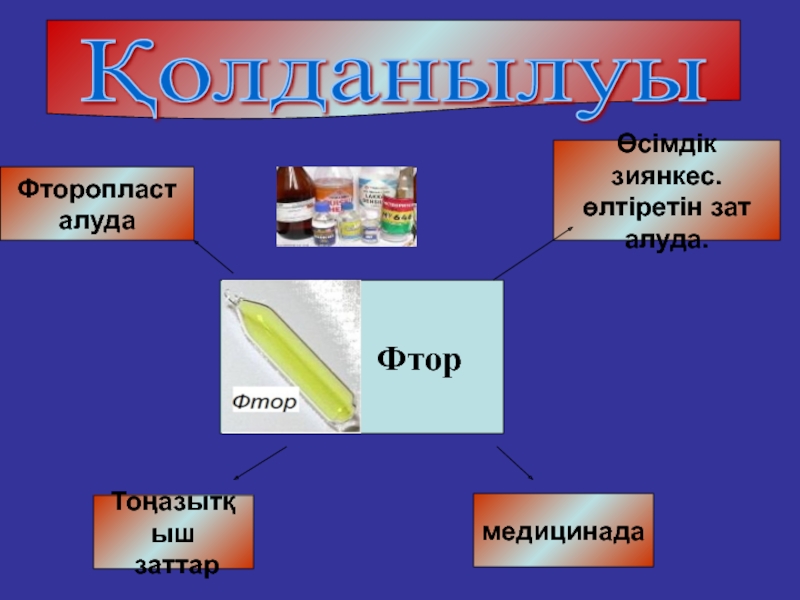
Қолданылуы
Фтор
Фторопласт
алуда
медицинада
Тоңазытқыш
заттар
Өсімдік зиянкес.
өлтіретін
алуда.
Слайд 13
Атом құрылысы.
Хлор III периодтың, VII топтың негізгі топшасының элементі, атомдық массасы-35,5. Ядросындағы протон сандары 17, яғни ядро заряды +17, электрондар саны 17, нейтрондар саны 18. Хлор атомының электрондық формуласы:ls2 2s2 2p6 3s2 3p5 валенттілік электрондары: 3s2 3p5 3d0.
Молекула құрылысы.
Хлор молекуласы да басқа галогендердікі сияқты екі атомды. Сl2 молекуласы хлордың 3р-деңгейшесінде орналасқан дара электрон бұлттарының қабысуынан болады, арасына бір байланыс түзіледі.
Слайд 14
Табиғатта таралуы.
Хлор табиғатта активті элемент болғандықтан тек қосылыстар күйінде кездеседі. Негізінен сілтілік және сілтілік-жер (II) металдарының хлоридтері күйінде олар:
карналлит KCl*MgCl2*6Н2О,
сильвинит NaCl*KCl,
бишофит MgCl2*6Н2О,
галит тас тұзы NaCl, т.б.
Слайд 15
Ашылуы:
Өндірісте хлорды ас тұзының балқымасын электролиздеу арқылы алынады. Осы әдіспен жұмыс істейтін зауыт Павлодарда орналасқан.
Карл Вильгельм Шееле 1774ж.щвед химигі
ашты.
Слайд 16
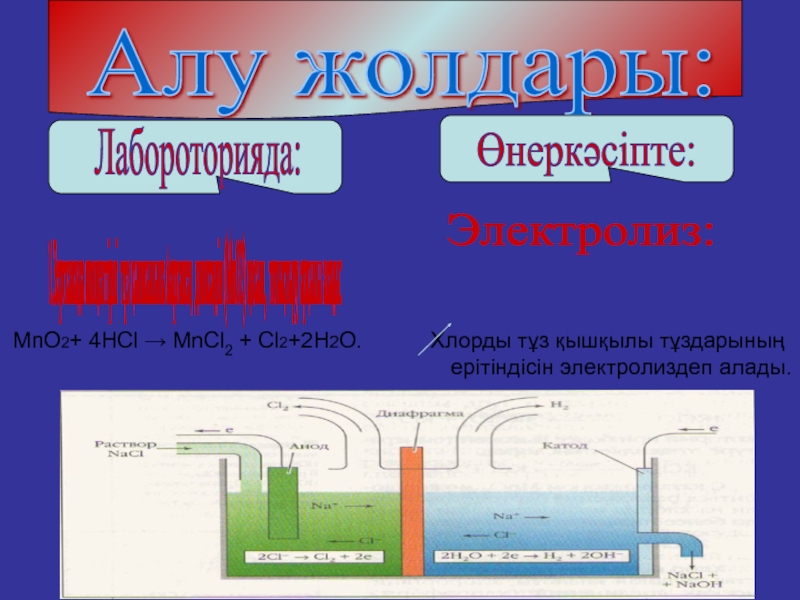
Алу жолдары:
Лабороторияда:
Өнеркәсіпте:
1.Зертханада концентірлі тұз қышкылына марганец
Электролиз:
MnO2+ 4HCl → MnCl2 + Cl2+2H2O. Хлорды тұз қышқылы тұздарының
ерітіндісін электролиздеп алады.
Слайд 17
Физикалық қасиеттері.
Хлор - сарғыш-жасыл түсті тұншықтырғыш улы газ. Онымен тек тартпа шкафтың ішінде жұмыс жасау керек. Хлор ауадан 2,5 еседей ауыр.
(Daya = М(Сl2)/М(ауа) = 71/29 = 2,45), сондықтан оны ауаны ығыстыру арқылы жинайды, ыдыстың аузын жоғары қаратып ұстауға да болады.
Суды ығыстыру арқылы жинауға болмайды,
себебі хлор сумен химиялық әрекеттесіп,
хлор «суын» түзеді.
Слайд 18
Хлор бос күйінде едәуір белсенді зат, алайда оның белсенділігі фторға қарағанда төмен. Хлор оттегі, азот және бекзат газдардан басқа жай заттардың барлығымен дерлік әрекеттеседі, ол үшін жылу бөлініп немесе жарықтандыру қажет.
Н2 + Сl2 = 2HCl өткір иісті хлорсутек түзіледі.
Химиялық қасиеттері.
Слайд 19
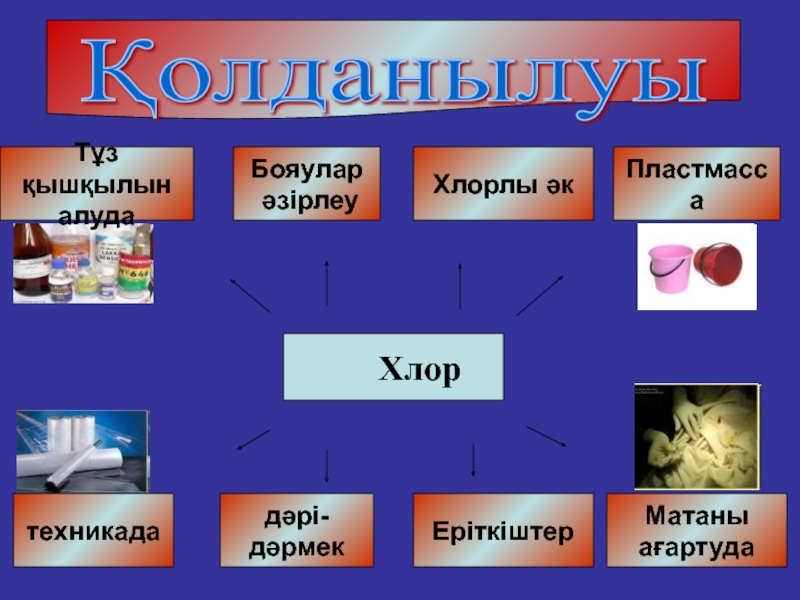
Қолданылуы
Хлор
Тұз қышқылын
алуда
Бояулар
әзірлеу
Матаны
ағартуда
Еріткіштер
Хлорлы әк
техникада
дәрі-
дәрмек
Пластмасса
Слайд 20
Бром мен йодтың салыстырмалы сипаттамалары.
Бром мен йод табиғатта бос күйінде кездеспейді және олардың,жеке табиғи минералдары да болмайды, тек хлор минералдарында (галит, карналлит, сильвинит) көбінесе сілтілік металдардың тұздары күйінде кейбір тұзды көлдер балдырларында және мұнай бұрғылағанда атқылап шығатын су құрамында болады.
Бром және Йод.
Слайд 21
Атом құрылысы.
Периодтық жүйенің IV периодында VIIA топшасында бром орналасса, V периодта VII топшада йод орналасқан.
Бромның 35 электроны төрт электрондық қабаттарда ядроны айналып жүреді, сыртқы қабатында орналасқан валенттік электрондарының формуласы - 4s2,4p5 болса, йодтың 53 электроны бес электрондық қабаттарға бөлініп орналасады, сыртқы қабатындағы валенттік электрондарынын, формуласы - 5s2,5p5.
Молекула құрылысы.
Басқа галогендер сияқты бром мен йод молекулалары да екі атомды. Олар бір-бірімен соңғы р-деңгейшелеріндегі бір дара электрондарының бұлттарының қабысуы арқылы түзілетін ковалентті полюссіз байланыс.
Слайд 22
Физикалық қасиеттері:
Бром Вr
Қара-сұр
Қызыл- күрең
балқу темп.113,6C
қайн,.темп.185,5
күлгін
сасық
Йод І
Қайнау темп..59,2
Балқу темп. -7,2
қатты
Слайд 23
Алынуы:
Бромды А. Ж. Балар (француз химигі) 1826 ж.,
йодты 1811 ж. Б. Куртуа
(француз химигі) ашқан.
Бром мен йодты, хлор сияқты, олардың қышқылдарына немесе тұздарына күшті тотықтырғыштармен әсер ету арқылы алуға болады.
Бернар Куртуа
БАЛАР Антуан Жером
30.09. 1802–30.03.1876 г.
Слайд 24
Қолданылуы
Бром
Бензинге
қоспалар
алуда
Фотобояу
әзірлеу
Ас тұзын
дайындау
Матор
майлары
медицинада
Бояғыш
заттар
Йод
Слайд 25
Астат-жасанды жолмен алынды,ыдырауға бейімдірадиоактивті,
көкшіл түсті кристалл зат.Ядролық реакциялар кезінде түзіледі.
Сегре, Эмилио Джино
Ашылуы:
Слайд 26
«Сен оқысаң-мен тоқығам».
(бұл бөлімде оқушылар жаңа сабақтан алған теориялық
білімдерін
1.Йод крахмалды анықтайды.
2.Хлордың бояғыш заттарға әсері.
Слайд 27
«Ізденген жетер мұратқа»
Есептер шығару.
1-тапсырма:Айналуларды іске асыруға болатын реакция теңдеулерін
жазыңдар:
Br2____HBr___NaBr___AgBr.
2-тапсырма:Берілген
14г хг
Si +2F2= SiF4.
Слайд 31 Галогендердің тотықтырғыштық қасиеті топ бойынша қалай өзгереді?.
Галогендер қосылыстарында қандай
Галогендердің салыстырмалы электртерістілігі топ байынша қалай өзгереді?
Слайд 32
Бағалау
Үйге тапсырма:
§6.17-6.18 Галогендер және олардың қосылыстары.
183 бет №7 есеп