- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Фосфор и его соединения
Содержание
- 1. Фосфор и его соединения
- 2. Не нужен университет, Ни Кембридж, и ни Оксфорд, Чтобы узнать: латинской «Р» Обозначают …
- 3. План урокаПаспортные данные фосфораСтанция историческаяСтанция «Аллотропные модификации»Станция геологическаяСтанция химическаяСтанция здоровьяСтанция прикладнаяСтанция поэтическаяСтанция контрольная
- 4. Паспортные данные фосфораПеречислите элементы V группы.Охарактеризуйте фосфор
- 5. Станция историческаяФосфор впервые получил в 1669 г.
- 6. К.В. Шееле (1742–1786) Вскоре Ю.
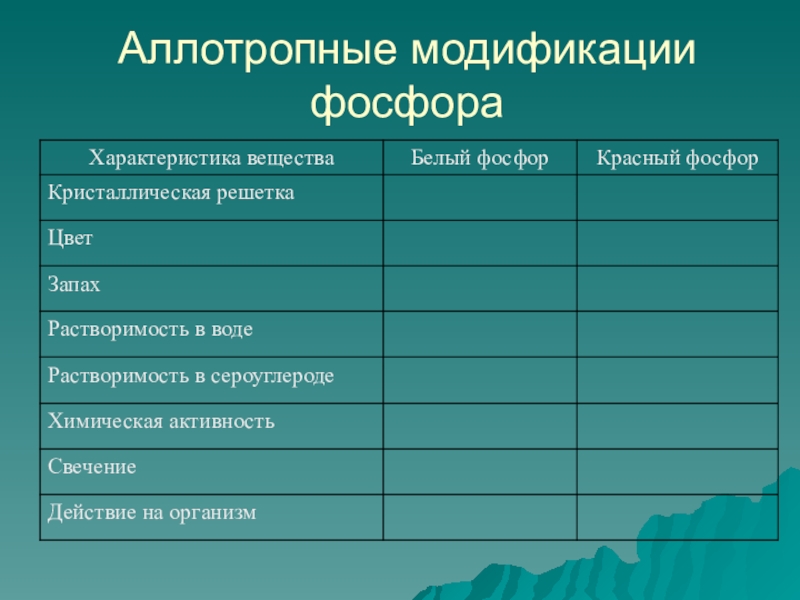
- 7. Аллотропные модификации фосфора
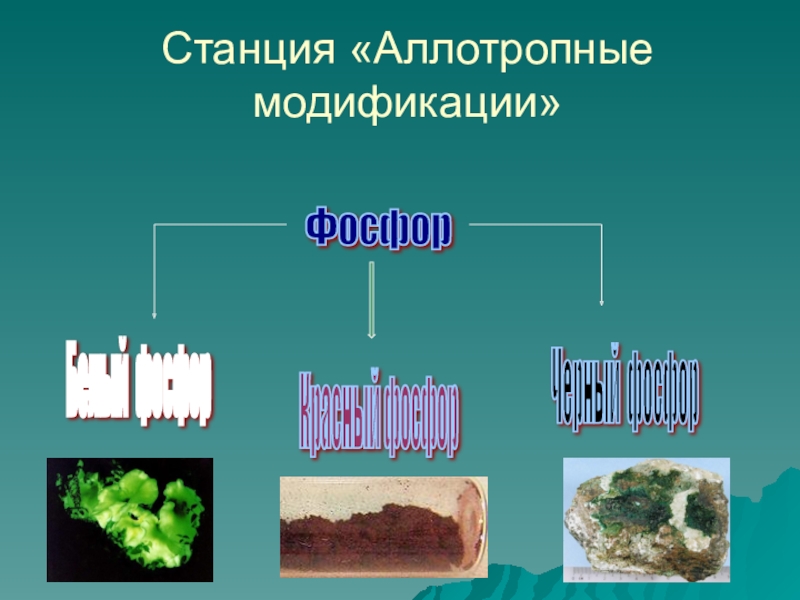
- 8. Станция «Аллотропные модификации»Фосфор Белый фосфор Красный фосфор Черный фосфор
- 9. Белый фосфорНаиболее распространен белый, или желтый, фосфор.
- 10. Красный фосфорАморфный темно-малиновый порошок без запаха. Менее
- 11. Черный фосфорРомбическая модификацияКубическая модификацияИмеет атомную кристаллическую решетку.
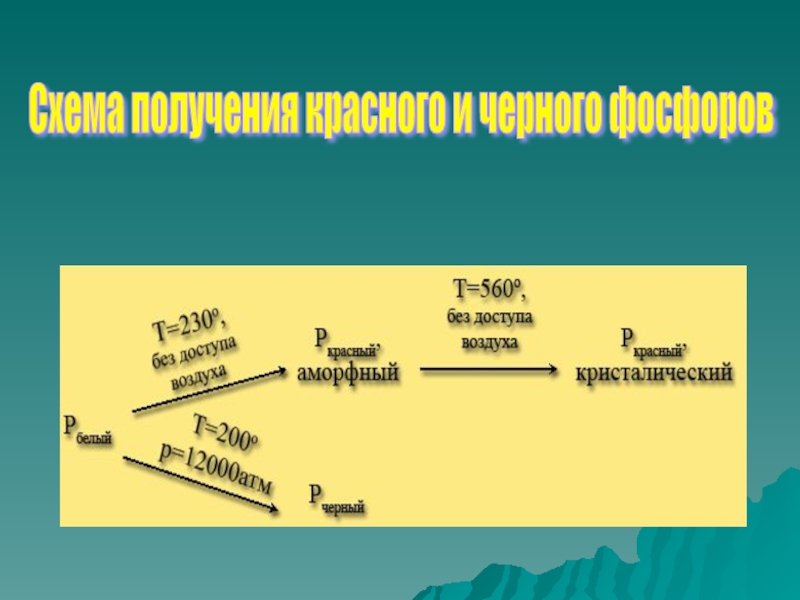
- 12. Схема получения красного и черного фосфоров
- 13. «Да! Это была собака, огромная, черная как
- 14. Станция геологическаяФосфор встречается в природе только в
- 15. Станция химическаяВзаимодействие с активными металлами: Mg + P
- 16. Станция здоровьяПо содержанию в организме человека фосфор
- 17. Фосфор и его воздействие на организм человекаКак
- 18. Пищевые источники фосфораПродукты, богатые белком, такие как
- 19. Станция прикладнаяБолее половины объема мирового производства фосфора
- 20. Станция поэтическая Я светоносный элемент. Я спичку вам зажгу
- 21. Знаете ли вы, что…пшеница при среднем урожае
- 22. Станция контрольная1. Сколько электронов в атоме фосфора
- 23. Домашнее задание§ 28 № 3, 4.Тетрадь на печатной основе, с. 113, № 1–4.
Слайд 3План урока
Паспортные данные фосфора
Станция историческая
Станция «Аллотропные модификации»
Станция геологическая
Станция химическая
Станция здоровья
Станция прикладная
Станция
Станция контрольная
Слайд 4Паспортные данные фосфора
Перечислите элементы V группы.
Охарактеризуйте фосфор по положению
в периодической
Опишите электронное строение атома фосфора.
В чем сходство и различие в строении атомов азота и фосфора?
Назовите возможные степени окисления фосфора.
Напишите формулу его высшего оксида, укажите его характер.
Напишите формулу гидроксида фосфора, укажите его характер.
Напишите формулу летучего водородного соединения фосфора.
У какого элемента сильнее выражены неметаллические свойства: а) азот, фосфор, мышьяк; б) кремний, фосфор, сера?
Слайд 5Станция историческая
Фосфор впервые получил в 1669 г. алхимик из Гамбурга Хеннинг
Свое название фосфор получил за способность светиться в темноте (греч. фосфор означает «светоносный»).
Слайд 6 К.В. Шееле
(1742–1786)
Вскоре Ю. Ган и К Шееле доказали,
Немного позже Ж. Пруст и М. Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция.
Антуан Лоран
Лавуазье
В начале 70-х гг. XVIII в. великий французский ученый А. Лавуазье, сжигая фосфор в замкнутом объеме воздуха, доказал, что фосфор – самостоятельный химический элемент.
В 1799 г. было доказано, что соединения фосфора необходимы для нормального развития растений.
Бриджмен
В 1847 г. немецкий химик Шретер получил красный фосфор. В 1934 г. американский ученый Бриджмен выделил черный фосфор. Впоследствии были выделены фиолетовый и коричневый фосфор.
Слайд 9Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.
Слайд 10Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор,
Слайд 11Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную кристаллическую решетку.
По внешним признакам черный
Наименее активный из всех модификаций.
Слайд 13«Да! Это была собака, огромная, черная как смоль… Из ее отверстой
Изучите аллотропные модификации фосфора и найдите ошибку в тексте. Заполните таблицу.
Слайд 14Станция геологическая
Фосфор встречается в природе только в связанном состоянии. Массовая доля
Важнейшие минералы:
Сa3(PO4)2 – фосфорит;
3Сa3(PO4)2∙Ca(OH)2 – гидроксиапатит;
3Сa3(PO4)2∙CaF2 – фторапатит.
В 1806 г. Ф. Велер предложил получение фосфора
из фосфата кальция, песка и угля. Расставьте коэффициенты в уравнении реакции с электронным балансом:
Слайд 15Станция химическая
Взаимодействие с активными металлами:
Mg + P →
Взаимодействие с кислородом:
Р +
Взаимодействие с бертолетовой солью:
Р + KClO3 → Р2О5 + KCl
Допишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.
Слайд 16Станция здоровья
По содержанию в организме человека фосфор относится к макроэлементам (w(Р)
Фосфор входит в состав костной, нервной и мозговой тканей, крови, молока.
Фосфором богаты яйца, мясо, молоко, хлеб.
Почти все важнейшие физиологические процессы, происходящие в организме человека, связаны с превращениями соединений фосфора.
Следите за своим здоровьем!
Слайд 17Фосфор и его воздействие на организм человека
Как и кальций, фосфор является
Фосфор помогает отфильтровывать отходы в почках и играет важную роль в том, как организм использует энергию. Он также помогает снизить боль в мышцах после тяжелой тренировки. Фосфор необходим для роста, восстановления и «ремонта» всех тканей и клеток.
Слайд 18Пищевые источники фосфора
Продукты, богатые белком, такие как мясо, птица, рыба, яйца,
Слайд 19Станция прикладная
Более половины объема мирового производства фосфора перерабатывается
в соединения, используемые
Соединения фосфора используют для получения антикоррозионных добавок к маслам и горючему для автомобилей.
Сульфиды фосфора стали необходимы в сражении с ржавчиной в металлургии.
Фосфор используется при производстве спичек.
Фосфор нужен для получения фосфористой бронзы.
Слайд 20Станция поэтическая
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня –
Я сразу стану кислотой.
Запишите уравнения реакций, о ко-
торых идет речь в этом стихотворе-
нии.
Слайд 21Знаете ли вы, что…
пшеница при среднем урожае из почвы берет в
исследования Луны показали присут-ствие там фосфора (w(Р) = 0,08%)?
каждый из нас носит в себе 4,5 кг фосфора в виде химических соединений?
свыше 85% содержащегося в организме фосфора приходится на долю костной ткани?
в Амстердаме в 1730 г. 31 г фосфора стоил около 80 золотых рублей?
Слайд 22Станция контрольная
1. Сколько электронов в атоме фосфора находится на внешнем энергетическом
1) 2 ; 2) 3; 3) 5; 4) 15.
2. Число нейтронов в ядре атома 31Р:
1) 5; 2) 15; 3) 16; 4) 31.
3. Максимальная степень окисления фосфора в соединениях равна:
1) +6; 2) +5; 3) +3; 4) +4.
4. При взаимодействии фосфора с активными металлами образуются соединения, в которых его степень окисления равна:
1) -3; 2) 0; 3) +3; 4) +5.
5. Среди перечисленных элементов V группы типичным неметаллом является:
1) фосфор; 2) мышьяк; 3) сурьма; 4) висмут.
6. В соединениях РН3, Р205, Н3Р03 фосфор имеет степени окисления, соответственно равные:
1) +3; +5; -3; 2) -3; +5; +3; 3) -3; +3; +5; 4) +3; -5; -3.