- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Фосфор и его соедиения
Содержание
- 1. Фосфор и его соедиения
- 2. ФОСФОР И ЕГО СОЕДИНЕНИЯУрок химиив
- 3. ЦЕЛИ: изучить фосфор как химический элемент и
- 4. ОТКРЫТИЕ ФОСФОРА1669 годГамбургский алхимикХеннинг Бранд
- 5. ПРИРОДНЫЕ СОЕДИНЕНИЯ Из-за большой химической активности встречается
- 6. ПОЛУЧЕНИЕ ФОСФОРА фосфорит + уголь + песок =
- 7. периодФосфор как химический элементIIIгруппаVАвалентных электронов5степени окисления-3, +3, +5высший оксидР2О5 водородное соединениеРН3
- 8. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА
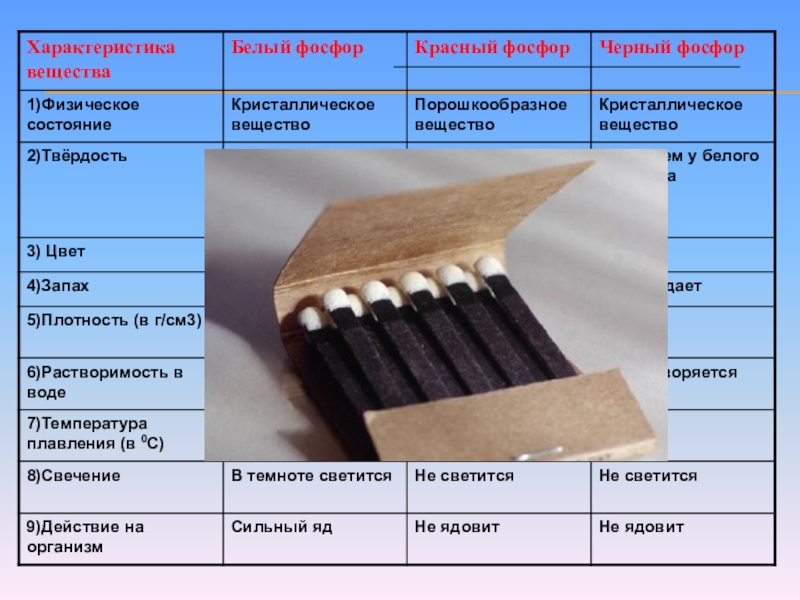
- 9. ФИЗИЧЕСКИЕ СВОЙСТВАЭлементарный фосфор в обычных условиях представляет
- 10. Слайд 10
- 11. Фосфор проявляет окислительные и
- 12. ОКСИД ФОСФОРА (V)Р2О5 – белый порошок, очень
- 13. ОРТОФОСФОРНАЯ КИСЛОТАПолучениеРО+НО225↔34РНО32═tВзаимодействие оксида фосфора (V) с водой
- 14. ОРТОФОСФОРНАЯ КИСЛОТАПолучениеCa PO4+HSO4↔322+()CaPO4HSO4КОНЦ.t↓3323═Вытеснение природных фосфатов более сильной
- 15. ОРТОФОСФОРНАЯ КИСЛОТА Ортофосфорная кислота – кристаллическое, нелетучее,
- 16. ПРИМЕНЕНИЕ ФОСФОРА
- 17. ?ЧесночныйОколо 44°СНе светитсяНе ядовит
- 18. 1 вариант2 вариант PH3+ HMnO4= MnO2+ H2O+
- 19. Новых тайн и открытий!
- 20. Слайд 20
Слайд 2ФОСФОР
И ЕГО СОЕДИНЕНИЯ
Урок химии
в классе
Подготовила учитель
Гуззитаева Марина Федровна
Слайд 3ЦЕЛИ:
изучить фосфор как химический элемент и простое вещество;
рассмотреть физико-химические свойства
определить области его применения.
???
Слайд 5ПРИРОДНЫЕ СОЕДИНЕНИЯ
Из-за большой химической активности встречается в природе только в
Важнейшими минералами фосфора являются:
Слайд 6ПОЛУЧЕНИЕ ФОСФОРА
фосфорит + уголь + песок = фосфор
1) Ca3(PO4)2 + 3SiO2
2) P2O5 + 5C → 2P + 5CO
________________________________________
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO
Слайд 7период
Фосфор как химический элемент
III
группа
VА
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
Р2О5
водородное соединение
РН3
Слайд 9ФИЗИЧЕСКИЕ СВОЙСТВА
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических
Слайд 11
Фосфор проявляет окислительные и восстановительные свойства.
О2 (изб.) + Р = Р2О5
О2 (недост.) + Р = Р2О3
H2+ P = PH3
P + H2 О = H3PO4 + H2
Фосфор – окислитель:
Р + Mg = Mg3P2
ХИМИЧЕСКИЕ СВОЙСТВА
5
4
2
3
4
2
2
2
3
4
4
10
16
2
3
Слайд 12ОКСИД ФОСФОРА (V)
Р2О5 – белый порошок, очень гигроскопичен (самый эффективный осушитель).
Является
Взаимодействует с основаниями и основными оксидами.
Оксиду фосфора (V) соответствует ортофосфорная кислота.
Слайд 13ОРТОФОСФОРНАЯ КИСЛОТА
Получение
Р
О
+
Н
О
2
2
5
↔
3
4
Р
Н
О
3
2
═
t
Взаимодействие оксида фосфора (V) с водой при нагревании.
Этим способом получают
Слайд 14ОРТОФОСФОРНАЯ КИСЛОТА
Получение
Ca
PO4
+
H
SO4
↔
3
2
2
+
(
)
Ca
PO4
H
SO4
КОНЦ.
t
↓
3
3
2
3
═
Вытеснение природных фосфатов более сильной кислотой при нагревании.
Фосфорная
Слайд 15ОРТОФОСФОРНАЯ КИСЛОТА
Ортофосфорная кислота –
кристаллическое,
нелетучее,
твердое,
бесцветное вещество.
Проявляет все свойства кислот.
Не является сильной в водном растворе.
Как трехосновная кислота, диссоциирует ступенчато.
Н3РО4 ↔ Н+ + Н2РО4― (дигидрофосфат-ион)
Н2РО4― ↔ Н+ + НРО42―(гидрофосфат-ион)
НРО42― ↔ Н+ + РО43―(фосфат-ион)
Фосфаты почти всех металлов в воде не растворимы.
Дигидрофосфаты всех металлов хорошо растворимы в воде.
Гидрофосфаты по растворимости занимают промежуточное положение.
Все нерастворимые в воде фосфаты растворяются в растворах сильных кислот.
Слайд 181 вариант
2 вариант
PH3+ HMnO4= MnO2+ H2O+ H3PO4
Ca3(PO4)2 + C +
? Решите окислительно-восстановительные реакции
3P⁻³H₃ + 8HMn⁺⁷O₄=3 H₃P⁺⁵O₄+ 8Mn⁺⁴O₂+ 4H₂O
P⁻³-8e → P⁺⁵|3 (ок-я,вос-ль)
Mn⁺⁷+3e → Mn⁺⁴|8(вос-ся,ок-ль)
2 Ca3(P ⁺⁵ O4)2 + 5 C0 + 6 SiO2 → P40 + 5 C ⁺⁴ O2 + 6 CaSiO3
4 P ⁺⁵ + 20 e- → P40 | 1 (вос-ся,ок-ль)
C0 - 4 e- → C ⁺⁴ | 5 (ок-я,вос-ль)