- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электронная презентация на тему: Элеткролиз 11 класс (базовый уровень)
Содержание
- 1. Электронная презентация на тему: Элеткролиз 11 класс (базовый уровень)
- 2. Электролиз – это окислительно-восстановительный процесс, протекающий на
- 3. Электролиз расплава• На катоде катионы металла
- 4. Электролиз расплава NaCl К(-)
- 5. Электролиз расплава СuCl2
- 6. Электролиз расплава NaOH К(-) NaOH А(+)
- 7. Электролиз в растворах (процесс на катоде)
- 8. Слайд 8
- 9. Процесс на аноде
- 10. Процесс на анодеб) Если анод инертный, то
- 11. Электролиз раствора NaCl
- 12. Электролиз раствора CuSO4
- 13. Электролиз раствора NaCl на растворимом
- 14. Получение и очистка металлов Чистые алюминий, магний, натрий, кадмий получают только электролизом
- 15. Получение щелочей, хлора, водорода и активных металлов (отбеливание тканей, производство лекарств, электроники, инертная среда)
- 16. Защита металлов от коррозии (гальваностегия) - покрыть
- 17. Копирование рельефных изделий из металлов и других
- 18. Проверь себя1. При электролизе раствора сульфата цинка
- 19. 3. При электролизе расплава
- 20. 5. Процесс на катоде при
- 21. 7. При электролизе 240 г 15%-го раствора
- 22. А теперь проверим ваши ответы!1-б 2-б 3-в, г 4-а, г 5-б 6- в 7- в 8-б
- 23. Домашнее задание:Учебник О.С.Габриеляна Химия 11 класс §18 (стр.217 - 222), упр. 22,23,25.
Слайд 1Электролиз
11 класс
(профильный уровень)
Работу выполнила
Еськова Анна Александровна
Слайд 2Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или
Слайд 3 Электролиз расплава
• На катоде катионы металла восстанавливаются до свободного металла:
Мn+
Анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например:
2Cl– – 2ē = Cl20
• Кислородсодержащие анионы не окисляются. Вместо анионов соли окисляется гидроксид-анион воды, и выделяется кислород:
4OH– – 4ē = O20 + 2H2O
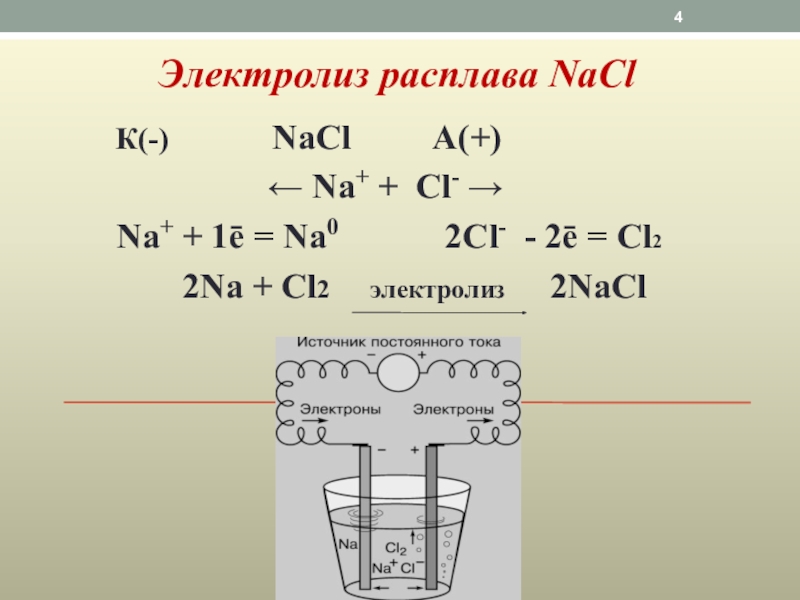
Слайд 4Электролиз расплава NaCl
К(-) NaCl А(+)
Na+ + 1ē = Na0 2Cl- - 2ē = Cl2
2Na + Cl2 электролиз 2NaCl
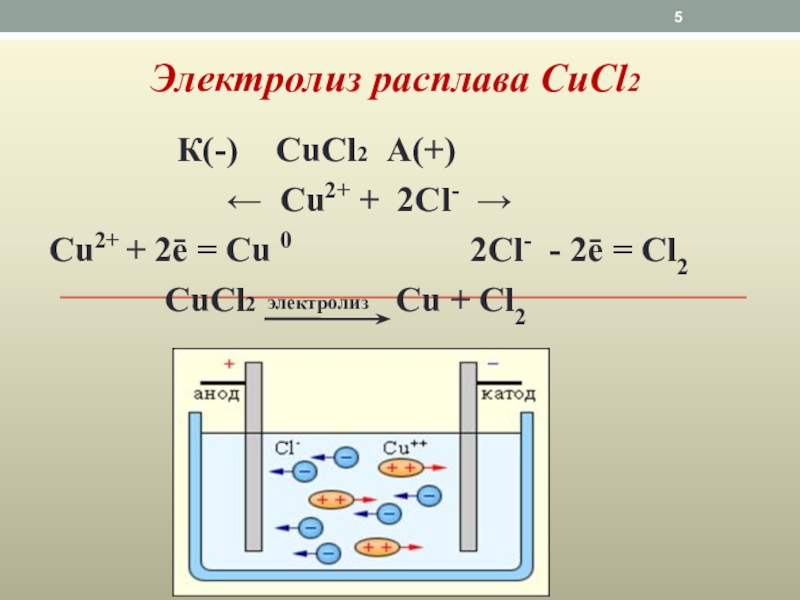
Слайд 5Электролиз расплава СuCl2
К(-)
← Cu2+ + 2Cl- →
Cu2+ + 2ē = Cu 0 2Cl- - 2ē = Cl2
CuCl2 Cu + Cl2
электролиз
Слайд 6Электролиз расплава NaOH
К(-) NaOH А(+)
Na+ + 1ē = Na0 4OH- - 4ē = 2 H2O + O2↑
4NaOH электролиз 4Na + O2↑ +2H2O
Слайд 7Электролиз в растворах
(процесс на катоде)
В растворах процесс на катоде не
а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды:
2Н2О + 2ē = H20 + 2OH–
Слайд 8
б) Если металл расположен в ряду напряжений между Al и H , то на катоде идут одновременно процессы восстановления воды и катионов металла:
2Н2О + 2ē = H20 + 2OH–
Мn+ + nē = М0
в) Если металл расположен в ряду напряжений после Н, то на катоде идет процесс восстановления катионов металла:
Мn+ + nē = М0
При электролизе растворов кислот идет процесс восстановления ионов водорода:
2Н+ + 2ē = H20
Слайд 9Процесс на аноде
В растворах процесс на аноде зависит от
Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото)
а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
Слайд 10Процесс на аноде
б) Если анод инертный, то в случае бескислородных анионов
2Cl– – 2ē = Cl20
В случае кислородсодержащих анионов и фторидов идет процесс ОКИСЛЕНИЯ ВОДЫ, анион при этом не окисляется и остается в растворе:
2H2O – 4ē = O20 + 4H+
При электролизе растворов щелочей идет окисление гидроксид-ионов:
4OH– – 4ē = O20 + 2H2O
Слайд 11Электролиз раствора NaCl
К(-) NaCl А(+)
← Na+ + Cl- →
2Н2О + 2ē = H2 + 2OH- 2Cl- - 2ē = Cl2↑
электролиз
2NaCl + 2H2O H2 + Cl2 +2NaOH
электролиз хлорида натрия.jpg
Слайд 12Электролиз раствора CuSO4
К(-) CuSO4 А(+)
← Cu2+ + SO42- →
Cu2+ + 2ē = Cu0 2H2O – 4ē = O2↑ + 4H+
электролиз
2CuSO4 + 2 H2O 2Cu + O2 + 2 H2SO4
Слайд 13Электролиз раствора NaCl
на растворимом аноде
К(-)
(Cu)
← Na+ + Cl- →
Cu2+ + 2ē = Cu0 Cu0 – 2ē =Cu2+
(т.к. Cu2+ в ряду напряжений стоят после H+)
Происходит переход ионов меди с анода на катод. Концентрация NaCl в растворе не меняется.
Слайд 14Получение и очистка металлов
Чистые алюминий, магний,
натрий, кадмий получают только
Слайд 15Получение щелочей, хлора, водорода и активных металлов (отбеливание тканей, производство лекарств,
Слайд 16Защита металлов от коррозии (гальваностегия) - покрыть изделие слоем благородного металла
Слайд 17Копирование рельефных изделий из металлов и других материалов (гальванопластика). Создание документально
Слайд 18Проверь себя
1. При электролизе раствора сульфата цинка с инертным электродами на
а) цинк; б) кислород; в) водород; г) сера.
2. При электролизе раствора хлорида натрия образуются: а) натрий и хлор; б) гидроксид натрия, хлор и водород; в) кислород и хлор; г) натрий, хлор и соляная кислота.
Слайд 19 3. При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий;
4. Платиновый электрод:
а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
Слайд 20 5. Процесс на катоде при электролизе растворов солей зависит от: а) природы
6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.