- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электролиз
Содержание
- 1. Электролиз
- 2. Электролиз – это окислительно – восстановительный процесс,
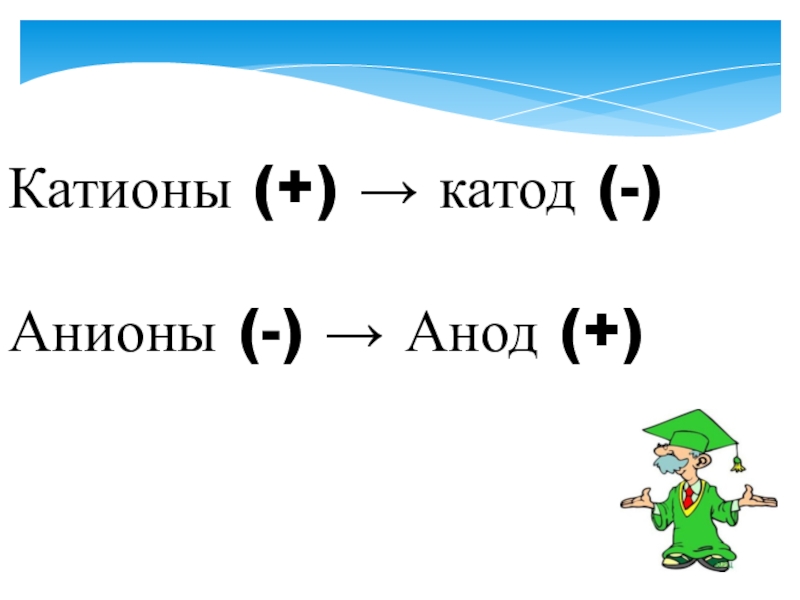
- 3. Катионы (+) → катод (-)Анионы (-) → Анод (+)
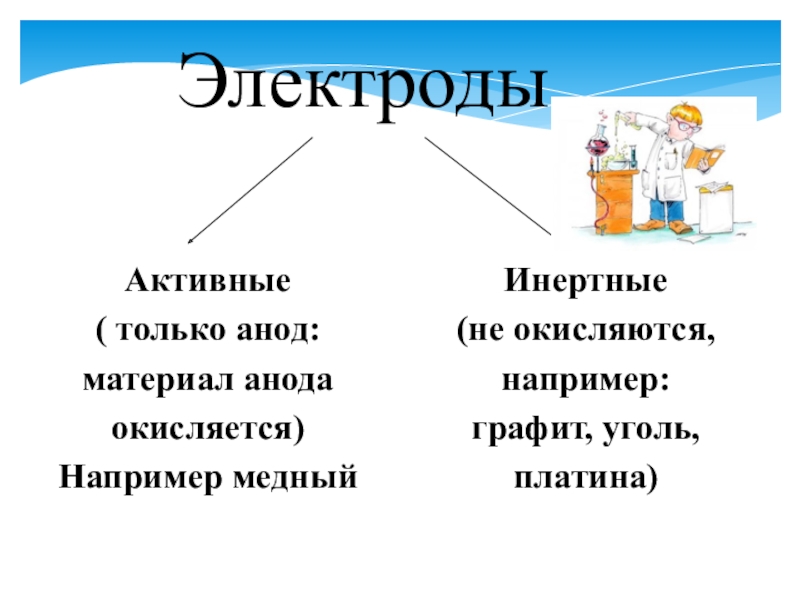
- 4. Электроды
- 5. 2 вида электролиза:- электролиз расплавов- электролиз растворов
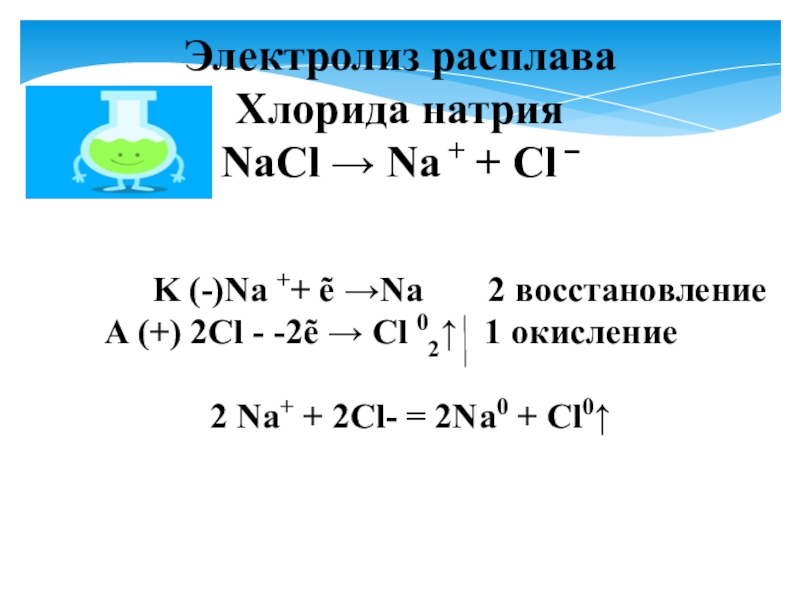
- 6. Электролиз расплаваХлорида натрияNaCl → Na + +
- 7. Электролиз растворов электролитов
- 8. Слайд 8
- 9. Правила восстановления анионов на аноде:a) если анод
- 10. SO4 2- ; NO3- ; PO 43-
- 11. NaCl = Na+ + Cl-
- 12. 2NaCl + 2 Н2О Электролиз Н2↑ + Cl20 ↑+ 2NaOH
- 13. Электролиз раствора сульфата меди (II) на нерастворимом
- 14. Cu2+ +2ẽ = Cu0
- 15. КОН = К+ +ОН-Электролиз раствора гидроксида калия
- 16. 2 Н2О+ 2 ẽ = Н2↑+ 2ОН-
- 17. Суммарное молекулярное уравнение:2 Н2О Электролиз 2Н2↑+ О2↑
- 18. б) Если анод РАСТВОРИМЫЙ, то окисляется металл
- 19. Схема электролиза раствора сульфата меди CuSO4
- 20. Задача Электролиз 200 г 14%-го раствора хлорида
- 21. решениеЗапишем уравнения реакций: 2NaCl + 2H2O =
- 22. Домашнее заданиеСоставить схему электролиза водного раствора хлорида
- 23. Спасибо за урок !
Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Слайд 1Тема урока: «Электролиз»
»
Учитель химии Тюбеева Танзиля Ахматовна
МКОУ «Гимназия №1» г.о.Нальчик
2020 год.
Слайд 2Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при
прохождении электрического тока через расплав или раствор электролита.
Слайд 6
Электролиз расплава
Хлорида натрия
NaCl → Na + + Cl –
K (-)Na ++ ẽ →Na 2 восстановление
A (+) 2Cl - -2ẽ → Cl 02↑ 1 окисление
2 Na+ + 2Cl- = 2Na0 + Cl0↑
A (+) 2Cl - -2ẽ → Cl 02↑ 1 окисление
2 Na+ + 2Cl- = 2Na0 + Cl0↑
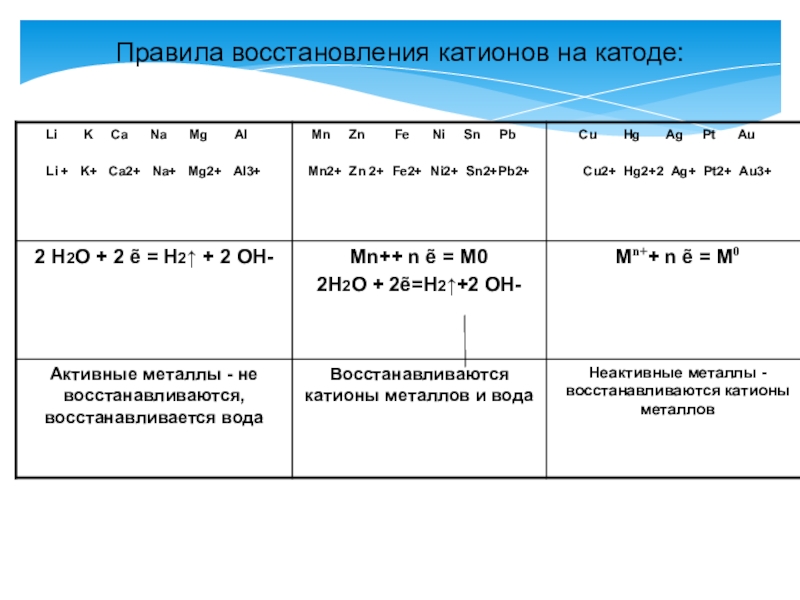
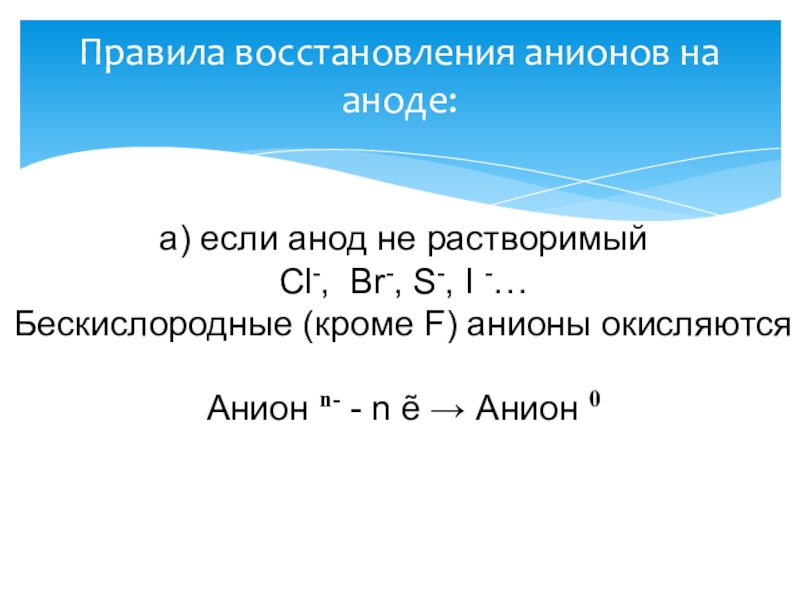
Слайд 9Правила восстановления анионов на аноде:
a) если анод не растворимый
Cl-, Br-,
S-, I -…
Бескислородные (кроме F) анионы окисляются
Анион n- - n ẽ → Анион 0
Бескислородные (кроме F) анионы окисляются
Анион n- - n ẽ → Анион 0
Слайд 10SO4 2- ; NO3- ; PO 43- ; СO32-
(кислородсодержащие анионы –
не окисляются, окисляется вода.)
В кислотной и нейтральной среде:
2H2O - 4 ẽ =O2↑ +4H -
В щелочной сфере:
4 OH - - 4 ẽ =O2↑ +4H +
В кислотной и нейтральной среде:
2H2O - 4 ẽ =O2↑ +4H -
В щелочной сфере:
4 OH - - 4 ẽ =O2↑ +4H +
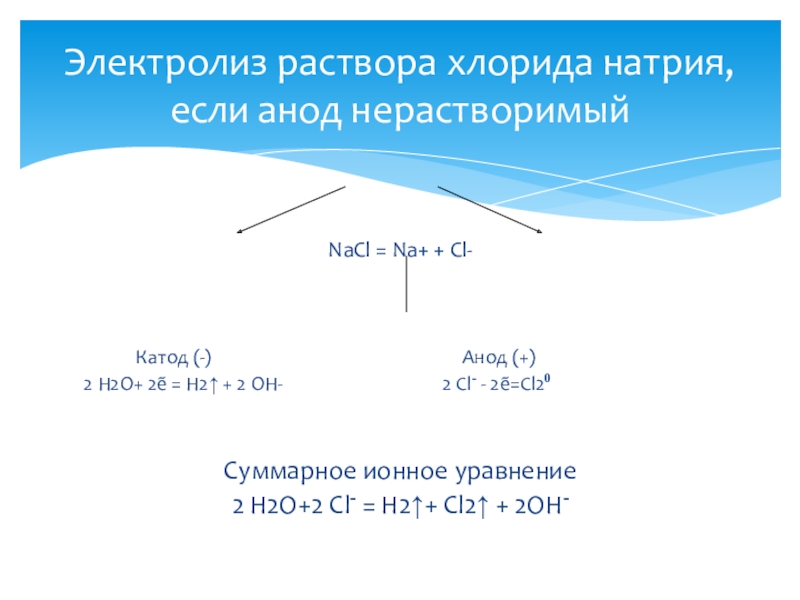
Слайд 11NaCl = Na+ + Cl-
Катод
(-) Анод (+)
2 Н2О+ 2ẽ = Н2↑ + 2 ОН- 2 Cl- - 2ẽ=Cl20
Суммарное ионное уравнение
2 Н2О+2 Cl- = Н2↑+ Cl2↑ + 2OH-
2 Н2О+ 2ẽ = Н2↑ + 2 ОН- 2 Cl- - 2ẽ=Cl20
Суммарное ионное уравнение
2 Н2О+2 Cl- = Н2↑+ Cl2↑ + 2OH-
Электролиз раствора хлорида натрия, если анод нерастворимый
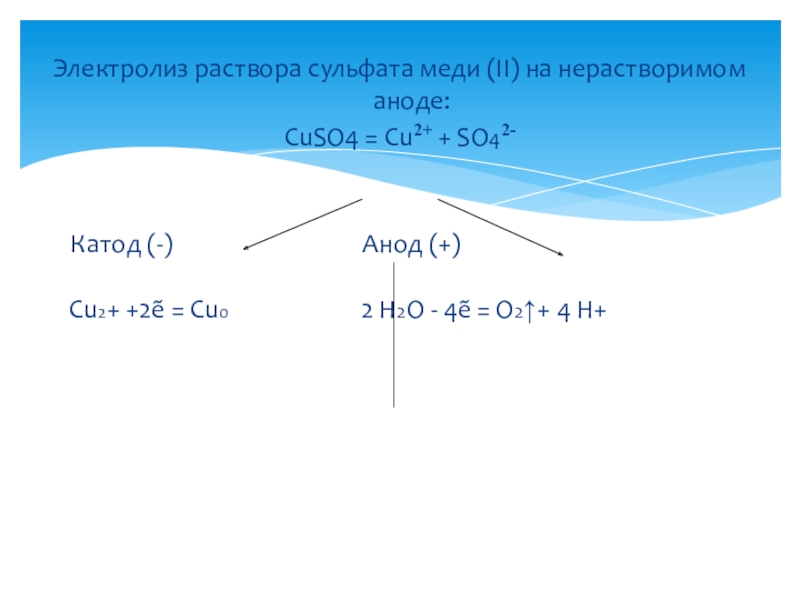
Слайд 13Электролиз раствора сульфата меди (II) на нерастворимом аноде:
CuSO4 = Cu2+ +
SO42-
Катод (-) Анод (+)
Cu2+ +2ẽ = Cu0 2 Н2О - 4ẽ = O2↑+ 4 H+
Катод (-) Анод (+)
Cu2+ +2ẽ = Cu0 2 Н2О - 4ẽ = O2↑+ 4 H+
Слайд 14Cu2+ +2ẽ = Cu0
2
2 Н2О - 4ẽ = O2↑+ 4 H+ 1
Суммарное ионное уравнение:
2 Cu2+ +2 Н2О= 2 Cu0+ O2↑+4 Н+
Суммарное молекулярное уравнение:
2 CuSO4 + 2 Н2О Электролиз 2 Cu+ O2+ 2 H2SO4
2 Н2О - 4ẽ = O2↑+ 4 H+ 1
Суммарное ионное уравнение:
2 Cu2+ +2 Н2О= 2 Cu0+ O2↑+4 Н+
Суммарное молекулярное уравнение:
2 CuSO4 + 2 Н2О Электролиз 2 Cu+ O2+ 2 H2SO4
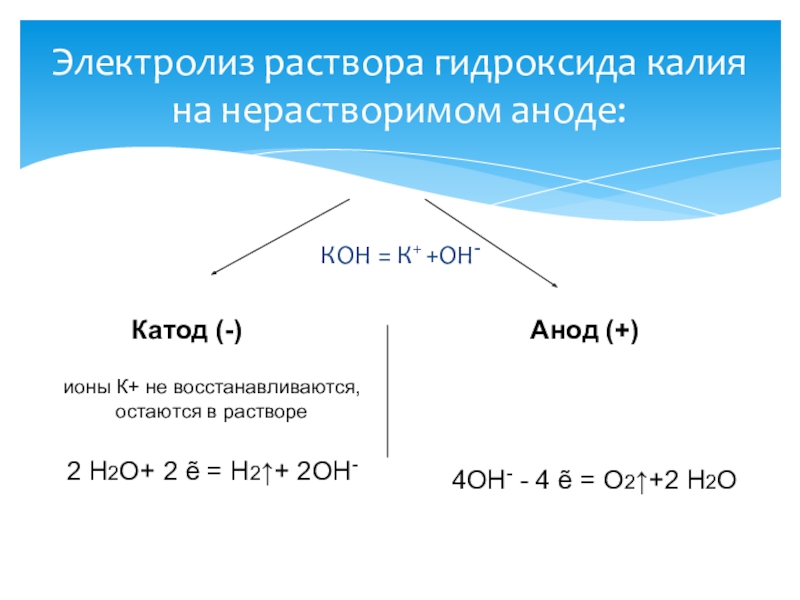
Слайд 15КОН = К+ +ОН-
Электролиз раствора гидроксида калия на нерастворимом аноде:
Катод (-) Анод (+)
ионы К+ не восстанавливаются,
остаются в растворе
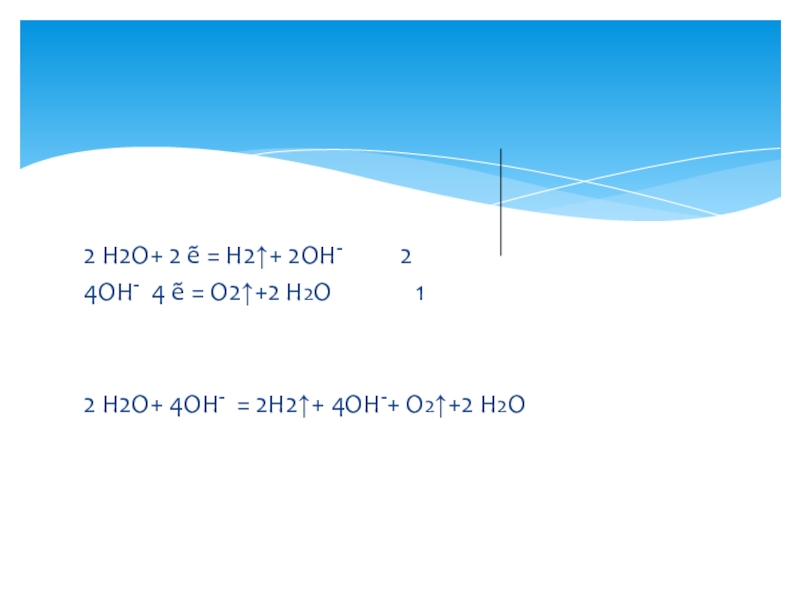
2 Н2О+ 2 ẽ = Н2↑+ 2ОН-
4ОН- - 4 ẽ = О2↑+2 Н2О
Слайд 18б) Если анод РАСТВОРИМЫЙ, то окисляется металл анода, несмотря на природу
аниона:
Mnn++ - n ẽ = M0
Анод Раствор
Mnn++ - n ẽ = M0
Анод Раствор
Слайд 19Схема электролиза раствора сульфата меди CuSO4 , если анод медный:
CuSO4
= Cu2+ + SO42-
АНОД: (+) Cu2+ -2ẽ = Cu0
КАТОД (-): Cu2+ +2ẽ = Cu0
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
АНОД: (+) Cu2+ -2ẽ = Cu0
КАТОД (-): Cu2+ +2ẽ = Cu0
Суммарное уравнение электролиза с растворимым анодом написать нельзя.
Слайд 20Задача
Электролиз 200 г 14%-го раствора хлорида натрия продолжали до тех
пор, пока на катоде не выделилось 5,6 л (н. у.) газа. К раствору, полученному после электролиза, прилили избыток раствора нитрата серебра. Вычислите массовые доли веществ в образовавшемся при этом осадке.
Слайд 21решение
Запишем уравнения реакций: 2NaCl + 2H2O = 2NaOH + H2 +
Cl2
2NaOH + 2AgNO3 = Ag2O↓ + 2NaNO3 + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
m(NaCl) = 200 ⋅ 0,14 = 28 г
n(NaCl) = 28 : 40 = 0,7 моль
n(H2) = 5,6 : 22,4 = 0,25 моль
Если бы хлорид натрия полностью подвергся электролизу, то количество выделившегося водорода составило бы 0,7 : 2 = 0,35 моль.
По условию n(H2) = 0,25 моль, то есть прореагировал не весь хлорид натрия. Расчет по первому уравнению ведем по водороду.
n(NaOH) = 2n(H2) = 0,5 моль
n(NaClразл.) = 2n(H2) = 0,5 моль
n(NaClост.) = 0,7 – 0,5 = 0,2 моль
Вычислим массовые доли веществ в осадке. n(Ag2O) = 0,5n(NaOH) = 0,25 моль
m(Ag2O) = 0,25 ⋅ 232 = 58 г
n(AgCl) = n(NaClост.) = 0,2 моль
m(AgCl) = 0,2 ⋅ 143,5 = 28,7 г
ω(Ag2O) = 58 : (58 + 28,7) ⋅ 100% = 66,9%
ω(AgCl) = 28,7 : (58 + 28,7) ⋅ 100% = 33,1%
Ответ: 66,9%; 33,1%
2NaOH + 2AgNO3 = Ag2O↓ + 2NaNO3 + H2O
NaCl + AgNO3 = AgCl↓ + NaNO3
m(NaCl) = 200 ⋅ 0,14 = 28 г
n(NaCl) = 28 : 40 = 0,7 моль
n(H2) = 5,6 : 22,4 = 0,25 моль
Если бы хлорид натрия полностью подвергся электролизу, то количество выделившегося водорода составило бы 0,7 : 2 = 0,35 моль.
По условию n(H2) = 0,25 моль, то есть прореагировал не весь хлорид натрия. Расчет по первому уравнению ведем по водороду.
n(NaOH) = 2n(H2) = 0,5 моль
n(NaClразл.) = 2n(H2) = 0,5 моль
n(NaClост.) = 0,7 – 0,5 = 0,2 моль
Вычислим массовые доли веществ в осадке. n(Ag2O) = 0,5n(NaOH) = 0,25 моль
m(Ag2O) = 0,25 ⋅ 232 = 58 г
n(AgCl) = n(NaClост.) = 0,2 моль
m(AgCl) = 0,2 ⋅ 143,5 = 28,7 г
ω(Ag2O) = 58 : (58 + 28,7) ⋅ 100% = 66,9%
ω(AgCl) = 28,7 : (58 + 28,7) ⋅ 100% = 33,1%
Ответ: 66,9%; 33,1%
Слайд 22Домашнее задание
Составить схему электролиза водного раствора хлорида меди(II) на угольных электродах
Составить
схему электролиза водного раствора
сульфата натрия на платиновых электродах
Задача
Раствор сульфата меди массой 96 г с содержанием соли 10% подвергли полному электролизу. Через образовавшийся после этого раствор пропустили 1344 мл (н.у.) аммиака. Вычислите массовую долю соли в полученном растворе
сульфата натрия на платиновых электродах
Задача
Раствор сульфата меди массой 96 г с содержанием соли 10% подвергли полному электролизу. Через образовавшийся после этого раствор пропустили 1344 мл (н.у.) аммиака. Вычислите массовую долю соли в полученном растворе