құрылысы .Атом құрылысы
Топ: АВС-20
Мамандық: 1201000 «Автомобиль көлігіне қызмет көрсету, жөндеу және пайдалану»
Күні: 25 .11. 14
Кабинет: 14
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Д. И Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылысы .Атом құрылысы
Содержание
- 1. Д. И Менделеев жасаған химиялық элементтердің периодтық жүйесінің құрылысы .Атом құрылысы
- 2. Cабақ барысы: 1 .Ұйымдастыру кезеңі 2мин
- 3. Сабақтың мақсаты:. Білімділік: Атом құрылысы туралы ілім
- 4. VДмитрий Иванович Менделеев – орыс химигі. .
- 5. Өмірі мен қызметі Менделеевтің әкесі осы қаладағы
- 6. Менделеевтің периодтық заңыМенделеевтің периодтық заңы, периодтық заң
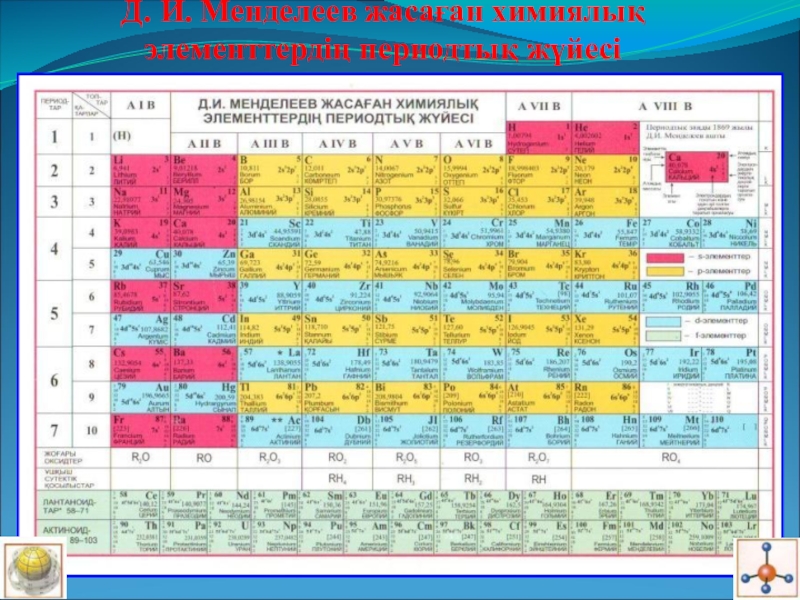
- 7. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесі
- 8. 2.ХЭПЖ құрылысы: периодтар,топтар,қатарлар,қосымша топшалар,табиғи ұяластар.Лантаноидтар, актиноидтар.Жоғары
- 9. Химиялық элементтердің қасиеттері не үшін атомдық массаларына
- 10. ==5. Ары қарай зерттеулер нәтижесі табиғатта бір
- 11. ==7. Қорытынды:Атом құрамына элементар бөлшектеркіреді: протондар, нейтрондар,
- 12. “Кім білімпаз?”Периоддегенімізне?.Периодтық кестедеқаншатоп бар? Периодтық заңның анықтамасыТоп
- 13. Атом-күрделі бөлшек.Ортасында ядро орналасқан, сыртында электрондар айналып
- 14. Берілген электрондық құрылыстың қай элементке сәйкес келетінін көрсет. (дұрыс тапсаң шар әуеге қалықтайды!)
- 15. V. Сабақты бекіту:1. ХЭПЖ кім ұсынды?2.ХЭПЖ неше
- 16. Студенттерді бағалау Үй тапсырмасы № 2,3, 7 есеп 64 бет
- 17. Қолданылған әдебиеттер“Химик анықтамалығы” №3-4 2009 жылН.Нұрахметов, т.б.
- 18. Зейін қойып тыңдағандарыңызға РАХМЕТ!
Cабақ барысы: 1 .Ұйымдастыру кезеңі 2мин 2. Үй тапсырмасын тексеру 10мин 3.Жаңа тақырыпты түсіндіру 25ми4.Жаттығу орындау 30мин 5.Жаңа
Слайд 2Cабақ барысы:
1 .Ұйымдастыру кезеңі 2мин
2. Үй тапсырмасын тексеру 10мин
3.Жаңа тақырыпты түсіндіру 25ми
4.Жаттығу орындау 30мин
5.Жаңа тақырыпты бекіту 8мин
6.Сабақ қорытындысы 3мин
7. Үй тапсырмасы 2vby
3.Жаңа тақырыпты түсіндіру 25ми
4.Жаттығу орындау 30мин
5.Жаңа тақырыпты бекіту 8мин
6.Сабақ қорытындысы 3мин
7. Үй тапсырмасы 2vby
Слайд 3Сабақтың мақсаты:
.
Білімділік: Атом құрылысы туралы ілім тұрғысынан периодтық заң және
химиялық элементтердің пероидтық жүйесінің маңызын студенттерге түсіндіріп, білімдерін қалыптастыру. Химиялық элементтердің атом құрылысы туралы алған білімдерін жетілдіру.
Дамытушылық: электрондық құрылысын,берілген ұғымдарды,период, топ нөмірінің физикалық мағынасын түсіндіре білу,химиялық элементтердің материалдық негізін ашу, қорытынды жасау ,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту;
Тәрбиелік: сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру
Дамытушылық: электрондық құрылысын,берілген ұғымдарды,период, топ нөмірінің физикалық мағынасын түсіндіре білу,химиялық элементтердің материалдық негізін ашу, қорытынды жасау ,жүйелеу, сөздік қорын молайту білім-білік дағдыларын дамыту;
Тәрбиелік: сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру
Слайд 4
V
Дмитрий Иванович Менделеев – орыс химигі.
. Менделеевтің периодтық заңы
Менделеевтің периодтық
заңы, периодтық заң – атомМенделеевтің периодтық заңы, периодтық заң – атом ядросы зарядтарының артуына байланысты химиялық элементтер қасиеттерінің периодты өзгеретінін тұжырымдайтын табиғаттың негізгі заңы. Бұл заңды 1869 ж. Дмитрий Менделеев ашты. Ол оның толық тұжырымдамасын 1871 ж. жариялады
Слайд 5Өмірі мен қызметі
Менделеевтің әкесі осы қаладағы гимназияның директоры болатын. Гимназияны аяқтағаннан
кейін ол Петербургтегі педагогика институтына түсіп, оны алтын медальмен бітіріп шықты (1857 ж.)
1859 жылы магистрлік диссертациясын қорғаған соң ол екі жылға Германияға ғылыми іс сапарға жіберілді. Қайтып оралған соң алдымен Петербург технологиялық институтының, екі жылдан кейін осы қаладағы университеттің профессоры болып сайланып, осы жерде 23 жыл бойына жемісті еңбек етті.
Д.И. Менделеев 1876 ж. Петербург Ғылым академиясының корреспондент мүшесі болып сайланды.
Ол 90-жылдардағы студенттер толқулары кезінде өз оқушыларының жағында болып, оларды қорғағаны үшін университеттен кетуге мәжбүр болды.
Д.И. Менделеев үнемі іздену үстінде көп жылдар бойы қарқынды еңбек еткен ғалым. Осы еңбектерінің ең биік шыңы, оны дүние жүзі ғалымдарының қатарына қосқан әрине, «Периодтық заңды» ашуы болды. Бұдан басқа ол «Ерітінділердің гидраттық теориясын» ұсынған, бұл еңбек әлі күнге дейін өзінің құндылығын жоғалтқан жоқ. Мұнан бөтен ол табиғи пайдалы қазбаларды жан-жақты толық пайдалануға, көптеген технологиялық үдерістердің ғылыми негізін қалауда да аса көп еңбек еткен ғалым.
Д.И. Менделеевтің «Химия негіздері» атты еңбегінде бейорганикалық қосылыстар химиясы периодтық заң тұрғысынан алғаш рет теориялық негізделіп түсіндірілді.
Өз заманының үлкен ойшыл ғалымы Д.И. Менделеевке ғылымға сіңірген теңдесі жоқ зор енбегі үшін Фарадей атындағы алтын медаль берілді.
1859 жылы магистрлік диссертациясын қорғаған соң ол екі жылға Германияға ғылыми іс сапарға жіберілді. Қайтып оралған соң алдымен Петербург технологиялық институтының, екі жылдан кейін осы қаладағы университеттің профессоры болып сайланып, осы жерде 23 жыл бойына жемісті еңбек етті.
Д.И. Менделеев 1876 ж. Петербург Ғылым академиясының корреспондент мүшесі болып сайланды.
Ол 90-жылдардағы студенттер толқулары кезінде өз оқушыларының жағында болып, оларды қорғағаны үшін университеттен кетуге мәжбүр болды.
Д.И. Менделеев үнемі іздену үстінде көп жылдар бойы қарқынды еңбек еткен ғалым. Осы еңбектерінің ең биік шыңы, оны дүние жүзі ғалымдарының қатарына қосқан әрине, «Периодтық заңды» ашуы болды. Бұдан басқа ол «Ерітінділердің гидраттық теориясын» ұсынған, бұл еңбек әлі күнге дейін өзінің құндылығын жоғалтқан жоқ. Мұнан бөтен ол табиғи пайдалы қазбаларды жан-жақты толық пайдалануға, көптеген технологиялық үдерістердің ғылыми негізін қалауда да аса көп еңбек еткен ғалым.
Д.И. Менделеевтің «Химия негіздері» атты еңбегінде бейорганикалық қосылыстар химиясы периодтық заң тұрғысынан алғаш рет теориялық негізделіп түсіндірілді.
Өз заманының үлкен ойшыл ғалымы Д.И. Менделеевке ғылымға сіңірген теңдесі жоқ зор енбегі үшін Фарадей атындағы алтын медаль берілді.
Слайд 6Менделеевтің периодтық заңы
Менделеевтің периодтық заңы, периодтық заң – атомМенделеевтің периодтық заңы, периодтық
заң – атом ядросы зарядтарының артуына байланысты химиялық элементтер қасиеттерінің периодты өзгеретінін тұжырымдайтын табиғаттың негізгі заңы. Бұл заңды 1869 ж. Дмитрий Менделеев ашты. Ол оның толық тұжырымдамасын 1871 ж. жариялады. Бұл заң элементтердің периодтық жүйесімен тығыз байланысты және бірін-бірі толықтырып, түсіндіреді. Ядроның заряды (Z) жүйедегі элементтердің атомдық нөміріне тең. Z өсуі бойынша орналасқан элементтер Z(Н, Нe, Lі, Be…) 7 период түзеді. 1-периодта – 2 элемент, 2 мен 3-те – 8-ден, 4 пен 5-те – 18-ден, 6-да – 32 элемент, 7-де – 23 элемент белгілі. Периодта элементтердің қасиеттері сілтілік металдардан инертті газдарға өткенде заңды түрде өзгереді. Вертикальды бағаналар – қасиеттері ұқсас элементтердің топтары болып табылады. Топтың ішінде элементтердің қасиеттері де заңды түрде өзгереді (мысалы, сілтілік металдарда Lі-ден Fr-ға дейін химиялық активтілік өседі). Z = 58 – 71, сол сияқты Z = 90 – 103 элементтерінің қасиеттері ұқсас болғандықтан лантаноидтар және актиноидтар қатарларына топтастырылған. Элементтер қасиеттерінің периодтылығы атомның сыртқы электрон қабаттарының конфигурациясының периодты қайталануына байланысты. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесіне сүйене отырып, ғалымдар атом құрылысы және химиялық байланыс теорияларын жасады; жер қыртысыжер қыртысы мен ғарыштық нысандаржер қыртысы мен ғарыштық нысандар зерттелді. Бұл заңның барлық жаратылыстанужер қыртысы мен ғарыштық нысандар зерттелді. Бұл заңның барлық жаратылыстану, техникажер қыртысы мен ғарыштық нысандар зерттелді. Бұл заңның барлық жаратылыстану, техника,технологияжер қыртысы мен ғарыштық нысандар зерттелді. Бұл заңның барлық жаратылыстану, техника,технология саласындағы ғылымдар үшін философиялық мәні зор.[2]
Менделеев Дмитрий Иванович
Мәселен, календарь, сағат немесе көбейту таблицасы тәрізді адам қажет етпей тұра алмайтын бір заттар болады. Химияның дәл сондай «көбейту таблицасы» химиялық элементтердің периодты системасы болып табылады. Оны 1869 жылы өз отандасымыз Д. И. Менделеев жасады.
Менделеев Дмитрий Иванович
Мәселен, календарь, сағат немесе көбейту таблицасы тәрізді адам қажет етпей тұра алмайтын бір заттар болады. Химияның дәл сондай «көбейту таблицасы» химиялық элементтердің периодты системасы болып табылады. Оны 1869 жылы өз отандасымыз Д. И. Менделеев жасады.
Слайд 82.ХЭПЖ құрылысы: периодтар,топтар,қатарлар,қосымша топшалар,табиғи ұяластар.Лантаноидтар, актиноидтар.Жоғары оксидтері.Сутекті газтәрізді қосылыстары.
Топтарда металдық қасиет жоғарыдан төмен қарай артады,бірақ мырыш қосымша топшада,мырыш қосылыстары екідайлы.
№2.Калий және бром атомдарының қасиеттерін салыстыру: калий –бұл сітілік металл, бром галогендерге жатады; әрбір период с.м.басталып инертті газбен аяқталады. Калийдің тотығу дәрежесі =(+1), бромдікі (-1). Электрондық формулалары: калий 2; 8; 8;1; бром 2;8;18;7. Калий –бұл s-элемент, электронын оңай беріп,күшті тотықсыздандырғыш қасиет көрсетеді.. Бромның 7 электроны бар,ол сыртқы қабатқа электрон қосып алады,ол күшті тотықтырғыш. Калий және мыс. Мыстың электрондық формулсы: 2;8;18;1. Оныншы d-электрон үшінші d –деңгейшеге өтеді нәтижесінде төртінші s-деңгейден секіреді,сондықтан электрон қозғалғыш. Мыс атомының тотығу дәрежесі (+1), (+2). Халькопирит, халькозин, малахит, азурит. Жезқазған, Жамбыл, ШҚО, Кенді Алтайда кездеседі.
Марганец және хлор.7 топ,қосымша топша.2,8,13,2, қосылыстары амфотерліБілімнің дамуының жаңа кезеңі периодтық заңның ашылуымен басталды-атом құрылысын зерттеу кезеңі басталды.Бұл өзара байланыс табиғатын терең түсіндіруге элементтердің бір-бірінен айырмашылығын,ПЗ заңдылықтарын түсіндіруге мүмкіндік берді.19ғасырдың соңында атом құрылысының күрделі екендігі ,олардың бір-біріне айналуы туралы бірқатар дәләлдер анықталды:
№2.Калий және бром атомдарының қасиеттерін салыстыру: калий –бұл сітілік металл, бром галогендерге жатады; әрбір период с.м.басталып инертті газбен аяқталады. Калийдің тотығу дәрежесі =(+1), бромдікі (-1). Электрондық формулалары: калий 2; 8; 8;1; бром 2;8;18;7. Калий –бұл s-элемент, электронын оңай беріп,күшті тотықсыздандырғыш қасиет көрсетеді.. Бромның 7 электроны бар,ол сыртқы қабатқа электрон қосып алады,ол күшті тотықтырғыш. Калий және мыс. Мыстың электрондық формулсы: 2;8;18;1. Оныншы d-электрон үшінші d –деңгейшеге өтеді нәтижесінде төртінші s-деңгейден секіреді,сондықтан электрон қозғалғыш. Мыс атомының тотығу дәрежесі (+1), (+2). Халькопирит, халькозин, малахит, азурит. Жезқазған, Жамбыл, ШҚО, Кенді Алтайда кездеседі.
Марганец және хлор.7 топ,қосымша топша.2,8,13,2, қосылыстары амфотерліБілімнің дамуының жаңа кезеңі периодтық заңның ашылуымен басталды-атом құрылысын зерттеу кезеңі басталды.Бұл өзара байланыс табиғатын терең түсіндіруге элементтердің бір-бірінен айырмашылығын,ПЗ заңдылықтарын түсіндіруге мүмкіндік берді.19ғасырдың соңында атом құрылысының күрделі екендігі ,олардың бір-біріне айналуы туралы бірқатар дәләлдер анықталды:
Слайд 9Химиялық элементтердің қасиеттері не үшін атомдық массаларына периодты түрде тәуелді?
Білімнің дамуының жаңа кезеңі периодтық заңның ашылуымен басталды.Бұл өзара байланыс табиғатын терең түсіндіруге элементтердің бір-бірінен айырмашылығын,ПЗ заңдылықтарын түсіндіруге мүмкіндік берді.19ғасырдың соңында атом құрылысының күрделі екендігі ,олардың бір-біріне айналуы туралы бірқатар дәләлдер анықталды:
==1. 20ғасырда ғалымдар атом ядродан және оның төңірегін айналып үнемі қозғалыста болатын электроннан тұратынын анықтады.Атом құрылысының теориясы ұсынылды.
А) 1897жылыД.Томсон электронды ашты;
Б) Француз ғалымыБеккерель радиоактивтілікті ашты.
В) Ерлі –зайыпты Кюрилер және Резерфорда радиоактивтілік сәуле шығарудың біркелкі еместігін зерттеді магнит өрісінде ол үшке айырылады,біреуінде заряд болмайтын сәуле- сәуле, ал қалған екі сәуле қарама -қарсы зарядталған .- сәулелер электрон ағынына тура келді,- сәулелер +2) зарядты гелий атомы болады.
Радиоактивтілік –кейбір элементтердің сәуле өткізу құбылысы , заттардан өтуі, фотографиялық пластинкаларды қарайту құбылысы.
==1. 20ғасырда ғалымдар атом ядродан және оның төңірегін айналып үнемі қозғалыста болатын электроннан тұратынын анықтады.Атом құрылысының теориясы ұсынылды.
А) 1897жылыД.Томсон электронды ашты;
Б) Француз ғалымыБеккерель радиоактивтілікті ашты.
В) Ерлі –зайыпты Кюрилер және Резерфорда радиоактивтілік сәуле шығарудың біркелкі еместігін зерттеді магнит өрісінде ол үшке айырылады,біреуінде заряд болмайтын сәуле- сәуле, ал қалған екі сәуле қарама -қарсы зарядталған .- сәулелер электрон ағынына тура келді,- сәулелер +2) зарядты гелий атомы болады.
Радиоактивтілік –кейбір элементтердің сәуле өткізу құбылысы , заттардан өтуі, фотографиялық пластинкаларды қарайту құбылысы.
Слайд 10==5. Ары қарай зерттеулер нәтижесі табиғатта бір атомның ядро зарядтары бірдей,
бірақ массалары әр түрлі болатын түрлерін ашты.Оларды- изотоптар деп атады.Әрбір изотоп атом массасы және ядро зарядымен сипатталады.Барлық химиялық элементтердің изотоптары бар.
==6. 20ғасырда 1930 жылдан кейін мүмкін болатын ядролық реакциялардың көптеген түрі ашылып,зерттелді.Ядролық реакциялардың көмегімен радиоактивті қасиеті бар изотоптар алынады.Олардың барлығы тұрақсыз,радиоактивті ыдырау нәтижесінде басқа элементтердің изотоптарына айналады.Атом құрылысының күрделілігі туралы алғашқы мәліметтер сұйықтықтар мен газдар арқылы электр тоғын өткізіп зерттегенде алынды. 19 ғасырдың отызыншы жылдарында атақты ағылшын ғалымы Фарадей тәжірибелері электр тоғы жеке зарядтар түрінде болады деген тұжырымға әкелді.Электр тоғының зарядының шамасын электр тоғын газдар арқылы өткізу тәжірибесі арқылы анықталды.Катодтық сәулелер -электрон деп аталатын теріс (-) зарядталған бөлшектер ағыны .
==6. 20ғасырда 1930 жылдан кейін мүмкін болатын ядролық реакциялардың көптеген түрі ашылып,зерттелді.Ядролық реакциялардың көмегімен радиоактивті қасиеті бар изотоптар алынады.Олардың барлығы тұрақсыз,радиоактивті ыдырау нәтижесінде басқа элементтердің изотоптарына айналады.Атом құрылысының күрделілігі туралы алғашқы мәліметтер сұйықтықтар мен газдар арқылы электр тоғын өткізіп зерттегенде алынды. 19 ғасырдың отызыншы жылдарында атақты ағылшын ғалымы Фарадей тәжірибелері электр тоғы жеке зарядтар түрінде болады деген тұжырымға әкелді.Электр тоғының зарядының шамасын электр тоғын газдар арқылы өткізу тәжірибесі арқылы анықталды.Катодтық сәулелер -электрон деп аталатын теріс (-) зарядталған бөлшектер ағыны .
Слайд 11==7. Қорытынды:
Атом құрамына элементар бөлшектеркіреді: протондар, нейтрондар, электрондар.
Химиялық элемент атомының негізгі
сипаттамасы - ядро заряды.
Ядро заряды элементтің реттік нөміріне сәйкес келеді.
Бір химиялық элемент ядродағы нейтрон саны әртүрлі изотоп түрінде бола алады.
Ядро заряды элементтің реттік нөміріне сәйкес келеді.
Бір химиялық элемент ядродағы нейтрон саны әртүрлі изотоп түрінде бола алады.
Слайд 12
“Кім білімпаз?”
Период
дегеніміз
не?.
Периодтық
кестеде
қанша
топ бар?
Периодтық
заңның
анықтамасы
Топ бойынша
қандай
элементтер
орналасады?
Периодтық
заңды
кім, қай жылы
ашты?
Атомның
құрамы
қандай?.
Периодтық
кестеде
неше
период бар?
Ядро
қандай
бөлшектерден
тұрады?
Изотоптар
дегеніміз
не?
Слайд 13
Атом-күрделі бөлшек.Ортасында ядро орналасқан, сыртында электрондар айналып жүреді.Осы электрондардың жолын электрондық
қабат немесе энергиялық деңгей дейміз.Энергиялық деңгейлерді 1,2,3, т.б. бүтін сандармен немесе латын әріптерімен белгілейміз: K L M N O P Q .
Әр энергиялық деңгейде бола алатын электрондар саны формуламен анықталады:
N=2n ² n-деңгей нөмірі. n=1 N=2*1² =2
n=2 N=2*2² =8
n=3 N=2*3² =18
n=4 N=2*4² =32
Период нөмірі – энергиялық деңгей санын көрсетеді.
Реттік нөмірі – электрон санын көрсетеді.
Әр энергиялық деңгейде бола алатын электрондар саны формуламен анықталады:
N=2n ² n-деңгей нөмірі. n=1 N=2*1² =2
n=2 N=2*2² =8
n=3 N=2*3² =18
n=4 N=2*4² =32
Период нөмірі – энергиялық деңгей санын көрсетеді.
Реттік нөмірі – электрон санын көрсетеді.
Слайд 14
Берілген электрондық құрылыстың қай элементке сәйкес келетінін көрсет.
(дұрыс тапсаң шар
әуеге қалықтайды!)
Слайд 15V. Сабақты бекіту:
1. ХЭПЖ кім ұсынды?
2.ХЭПЖ неше период бар?
3.Жалпы элементтер нешеге
бөлінеді ?
4.Топ номері неге сәйкес келеді?
5.Химиялық элемент дегеніміз не?.
4.Топ номері неге сәйкес келеді?
5.Химиялық элемент дегеніміз не?.
Слайд 17
Қолданылған әдебиеттер
“Химик анықтамалығы” №3-4 2009 жыл
Н.Нұрахметов, т.б. Химия 10-сынып.
Алматы “Мектеп” 2006 жыл
3. Б.Бірімжанов, Н.Нұрахметов Жалпы химия
Алматы “Кітап” 1992 жыл
4. “Химия мектепте” №5 2004 жыл, №4 2005 жыл
5. “Краткий химический справочник” В.А.Рабинович, З.Я.Хавин
3. Б.Бірімжанов, Н.Нұрахметов Жалпы химия
Алматы “Кітап” 1992 жыл
4. “Химия мектепте” №5 2004 жыл, №4 2005 жыл
5. “Краткий химический справочник” В.А.Рабинович, З.Я.Хавин