- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Азотная кислота. Свойства. Применения. Реакции
Содержание
- 1. Азотная кислота. Свойства. Применения. Реакции
- 2. HNO3 Азотная кислотаHNO3 - один из важнейших
- 3. Получение 1. Лабораторный способ:KNO3 + H2SO4(конц)
- 4. Химические свойства Очень сильная кислота. Диссоциирует в
- 5. Вытесняет слабые кислоты из их солей2HNO3 +
- 6. Специфические свойства азотной кислоты Сильный окислитель1. Разлагается
- 7. HNO3 Концентрированная Fe, Al, Cr, Au, Pt
- 8. 4. С неметаллами:Азотная кислота превращается в NO
- 9. Применение Как сырьё для производства удобрений: калийной
HNO3 Азотная кислотаHNO3 - один из важнейших промышленных химических продуктов, бесцветная, прозрачная жидкость с резким, неприятным запахом. При нагревании, или под действием света приобретает бурый оттенок вследствие частичного разложения по схеме: 4HNO3 → 4NO2 + 2H2O
Слайд 2HNO3 Азотная кислота
HNO3 - один из важнейших промышленных химических продуктов, бесцветная,
прозрачная жидкость с резким, неприятным запахом. При нагревании, или под действием света приобретает бурый оттенок вследствие частичного разложения по схеме:
4HNO3 → 4NO2 + 2H2O + O2
4HNO3 → 4NO2 + 2H2O + O2
Слайд 3
Получение
1. Лабораторный способ:
KNO3 + H2SO4(конц) –t°→ KHSO4 + HNO3
2. Промышленный способ.
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt → 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt → 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
Слайд 4Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3
↔ H+ + NO3-
Реагирует:
с основными оксидами
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- → Cu2+ + 2NO3- + H2O
или CuO + 2H+ → Cu2+ + H2O
с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
или H+ + OH- → H2O
Реагирует:
с основными оксидами
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- → Cu2+ + 2NO3- + H2O
или CuO + 2H+ → Cu2+ + H2O
с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
или H+ + OH- → H2O
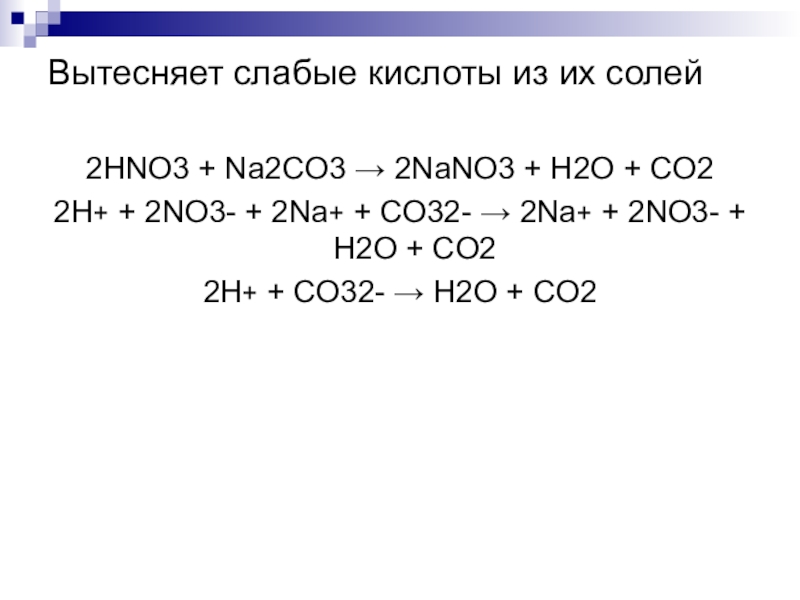
Слайд 5Вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 +
H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
Слайд 6Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при
нагревании
4HNO3 –t°,hv→ 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ
4HNO3 –t°,hv→ 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ
Слайд 7 HNO3
Концентрированная
Fe, Al, Cr, Au, Pt
пассивирует (без нагревания)
с тяжелыми металлами
NO2
со
щелочными и щел.зем. металлами
N2O
Разбавленная
с тяжелыми металлами NO
со щелочными и щел.зем. металлами, а также Sn и Fe NH3 (NH4NO3)
Разбавленная
с тяжелыми металлами NO
со щелочными и щел.зем. металлами, а также Sn и Fe NH3 (NH4NO3)
Слайд 84. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы
окисляются до соответствующих кислот:
S° + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B° + 3HNO3 → H3B+3O3 + 3NO2
3P° + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
S° + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B° + 3HNO3 → H3B+3O3 + 3NO2
3P° + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
Слайд 9Применение
Как сырьё для производства удобрений: калийной селитры KNO3, натриевой селитры
NaNO3, аммиачной селитры NH4NO3, комплексных минеральных удобрений;
как нитрующий реагент в производстве взрывчатых веществ (тринитроглицерина, тринитротолуола, гексогена и пр.);
как окисляющий агент двухкомпонентных ракетных топлив, например, в смеси с 1,1-диметилгидразином;
как реагент в нитрозном способе получения серной кислоты;
для получения нитроцеллюлозы;
для получения ароматических нитросоединений - прекурсоров красителей, фармакологических препаратов и прочих соединений, используемых в тонком органическом синтезе;
для травления металлов и полупроводниковых материалов;
как нитрующий реагент в производстве взрывчатых веществ (тринитроглицерина, тринитротолуола, гексогена и пр.);
как окисляющий агент двухкомпонентных ракетных топлив, например, в смеси с 1,1-диметилгидразином;
как реагент в нитрозном способе получения серной кислоты;
для получения нитроцеллюлозы;
для получения ароматических нитросоединений - прекурсоров красителей, фармакологических препаратов и прочих соединений, используемых в тонком органическом синтезе;
для травления металлов и полупроводниковых материалов;