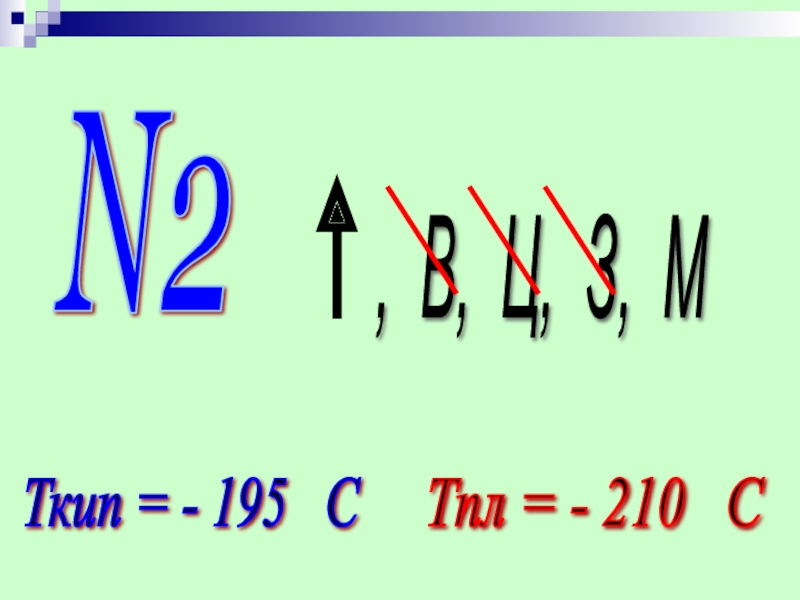- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Азот и его соединения
Содержание
- 1. Азот и его соединения
- 2. ЦЕЛЬ:ПОВТОРЕНИЕ И УГЛУБЛЕНИЕ ЗНАНИЙ О ХИМИЧЕСКИХ И БИОЛОГИЧЕСКИХ СВОЙСТВАХ АЗОТА И ЕГО СОЕДИНЕНИЯХ
- 3. Постановка проблемы«АЗОТ: БЕЗЖИЗНЕННЫЙ ЭЛЕМЕНТ ИЛИ ВАЖНАЯ СОСТАВНАЯ ЧАСТЬ ЖИЗНИ НА ЗЕМЛЕ?»
- 4. «НЕТ ЖИЗНИ БЕЗ АЗОТА, ИБО ОН ЯВЛЯЕТСЯ ВАЖНЕЙШЕЙ СОСТАВЛЯЮЩЕЙ ЧАСТЬЮ БЕЛКОВОЙ МОЛЕКУЛЫ» Д.Н. ПРЯНИШНИКОВ
- 5. История открытия азота. Нахождение в природе.Азот. Свойства.
- 6. ИСТОРИЯ ОТКРЫТИЯ АЗОТАВ 1772 году английский химикГенри
- 7. В 1773 году шведский химик-аптекарь Карл Шееле
- 8. Нахождение в природеАзот – один из распространенных
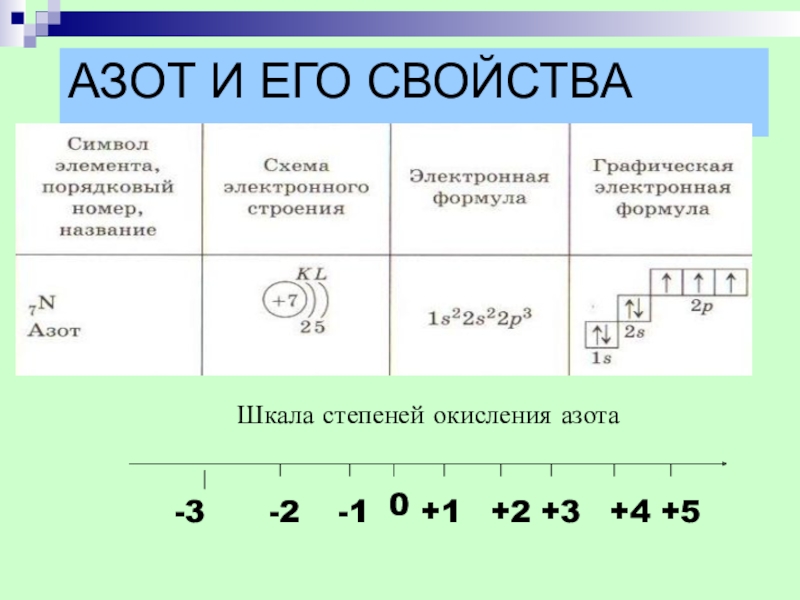
- 9. АЗОТ И ЕГО СВОЙСТВАШкала степеней окисления азота-3-3-2-10+1+2+3+4+5
- 10. N2 , В, Ц, З, М Ткип
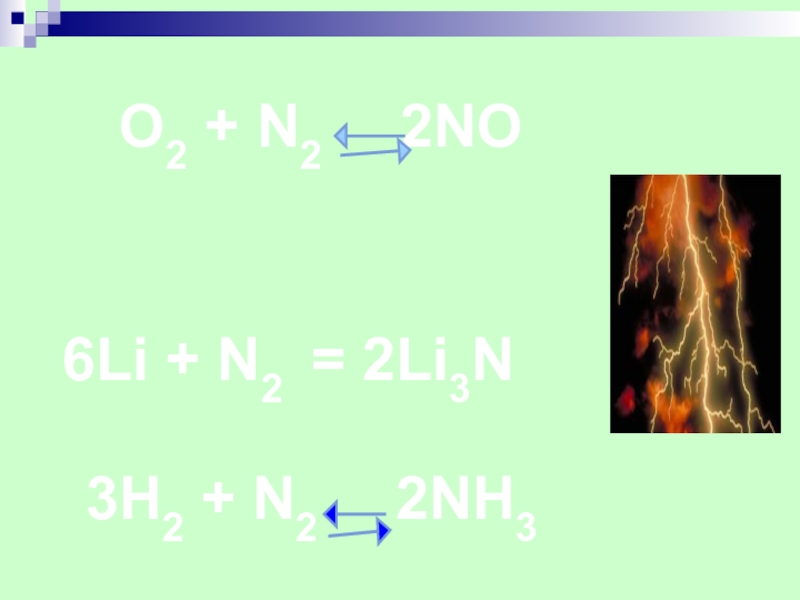
- 11. 6Li + N2 = 2Li3N
- 12. ПОЛУЧЕНИЕ АЗОТАВ промышленностиВ лаборатории:NH4NO2 = N2 + 2H2O
- 13. N2 Жидкий азот в медицине Синтез аммиака Синтез азотной кислоты Производство удобрений Создание инертной среды
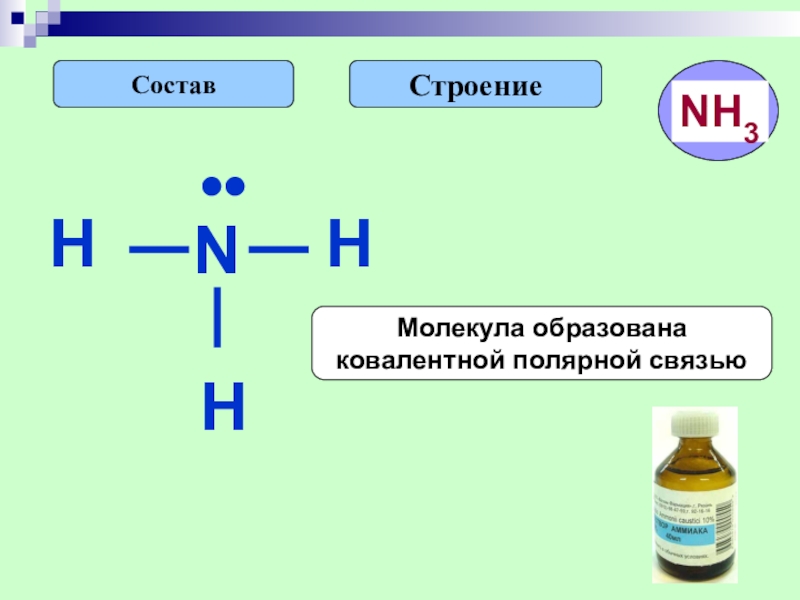
- 14. СтроениеСоставH••NHHМолекула образована ковалентной полярной связью
- 15. СтроениеСвойства физическиеМолекулярная кристаллическая решеткаЛегче воздухаХорошо растворим в водеH2ONH3
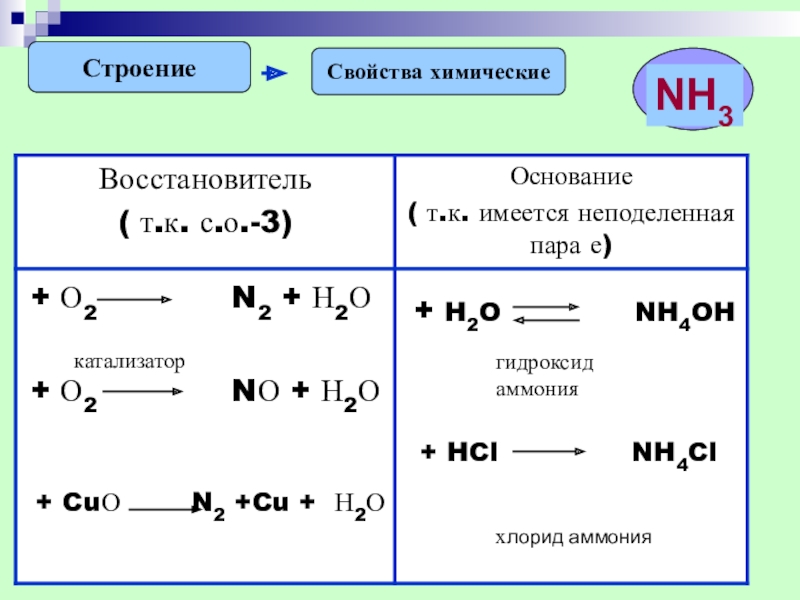
- 16. СтроениеСвойства химическиегидроксид аммонияхлорид аммония
- 17. ПрименениеПолучениеВ лабораторииNH4ClCa(OH)2
- 18. ПрименениеПолучениеВ промышленноститеплообменниккатализатортурбокомпрессорСмесь азота и водородахолодильниксепаратор NH3
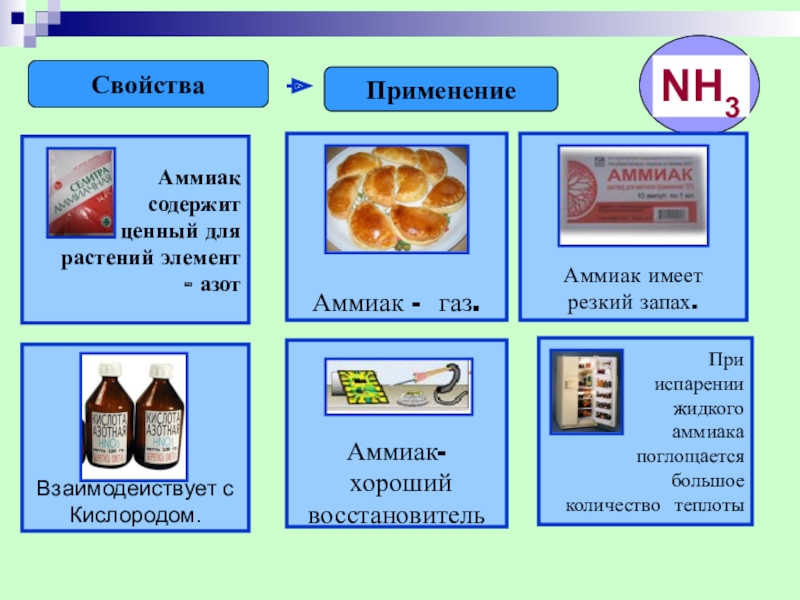
- 19. СвойстваПрименение
- 20. АММИАК В МЕДИЦИНЕ
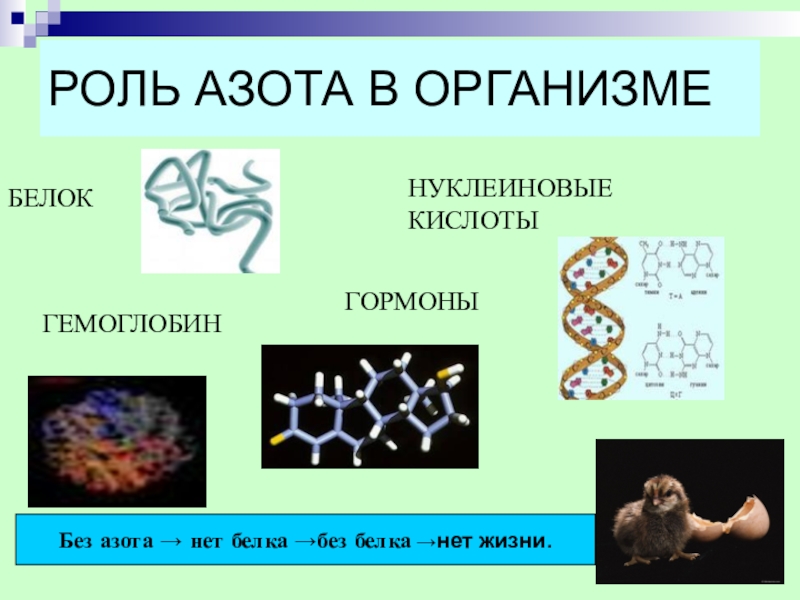
- 21. РОЛЬ АЗОТА В ОРГАНИЗМЕБЕЛОКНУКЛЕИНОВЫЕ КИСЛОТЫГЕМОГЛОБИН ГОРМОНЫ Без азота → нет белка →без белка →нет жизни.
- 22. АЗОТ В ЖИЗНИ РАСТЕНИЙзамедляется рост растенияобразование хлорофилла
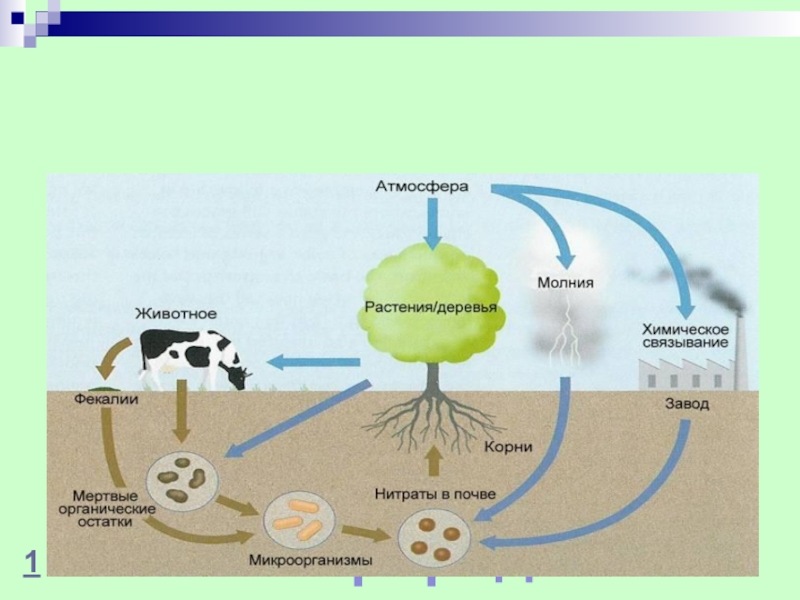
- 23. Круговорот азота в природе1
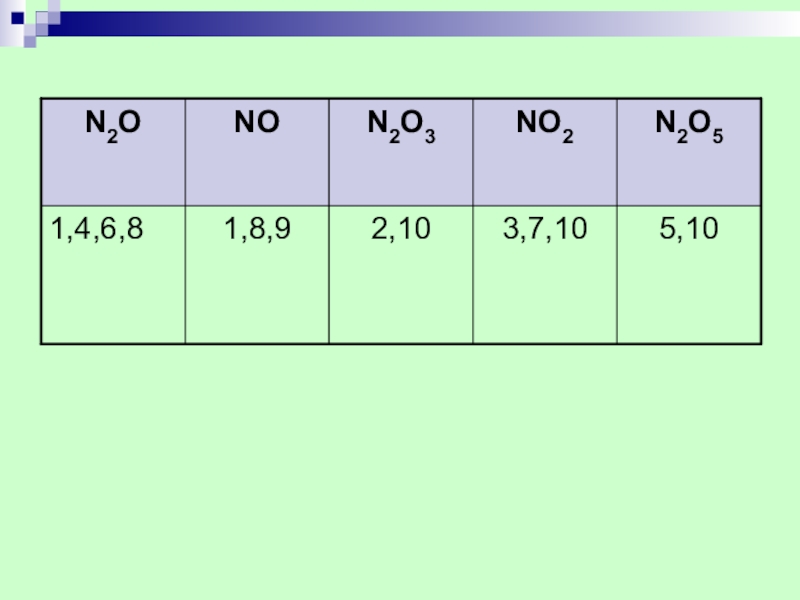
- 24. ОКСИДЫ АЗОТАСолеобразующие: N2O3 NO2 N2O5Несолеобразующие: N2O NO
- 25. Молекула линейнаБесцветный газ со слабым запахом и
- 26. Бесцветный газ, не имеет запаха. В воде
- 27. Кислотный оксид:N2O3 + H2O = 2HNO2N2O3 +
- 28. Кислотный оксид:
- 29. Кислотный оксид:N2O5 + H2O == 2HNO3 Легко
- 30. «Азотная кислота» По основности:
- 31. Ж., з., ρ = 1,51 г/см3, tпл
- 32. Химические свойства «Азотная кислота по
- 33. С основаниями (нерастворимыми):Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2OС растворимыми
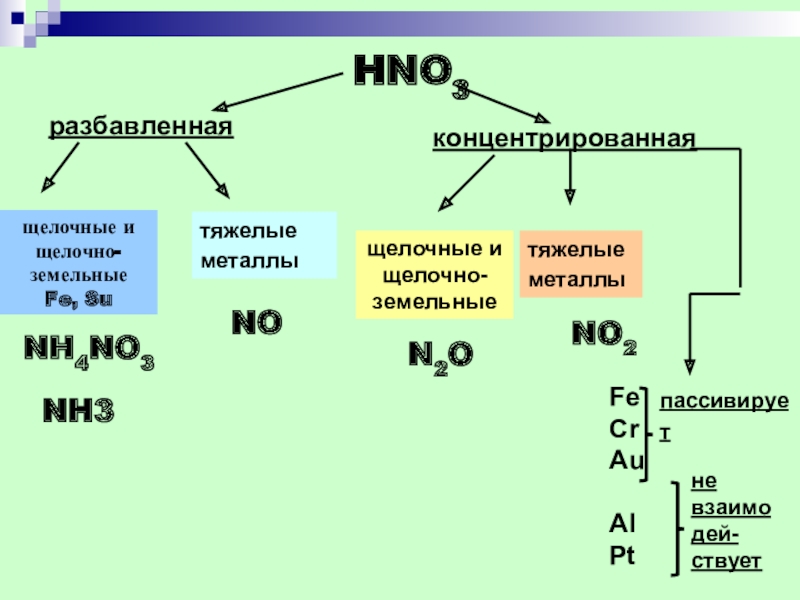
- 34. HNO3 разбавленная концентрированнаящелочные и щелочно-земельныеFe, Su тяжелые металлы щелочные и щелочно-земельныетяжелые металлы NO2FeCrAuAlPtпассивирует не взаимодей-ствуетN2ONONH4NO3NH3
- 35. Азотная кислота взаимодействует со многими неметаллами, окисляя
- 36. HNO3
- 37. СОЛИ СОЕДИНЕНИЙ АЗОТАСелитры – соли азотной кислоты
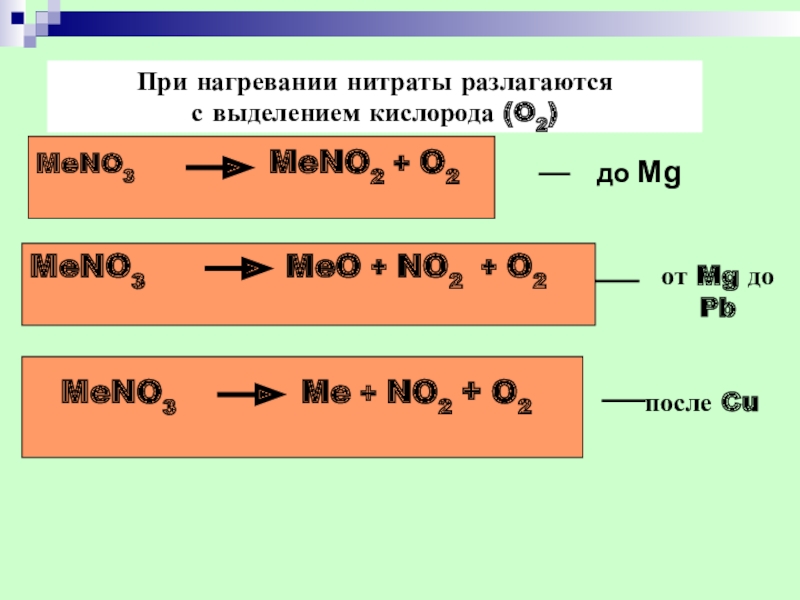
- 38. При нагревании нитраты разлагаются с выделением кислорода
- 39. соли аммония - взаимодействии аммиака или
- 40. 1.БЕСЦВЕТНЫЙ ГАЗ
- 41. Слайд 41
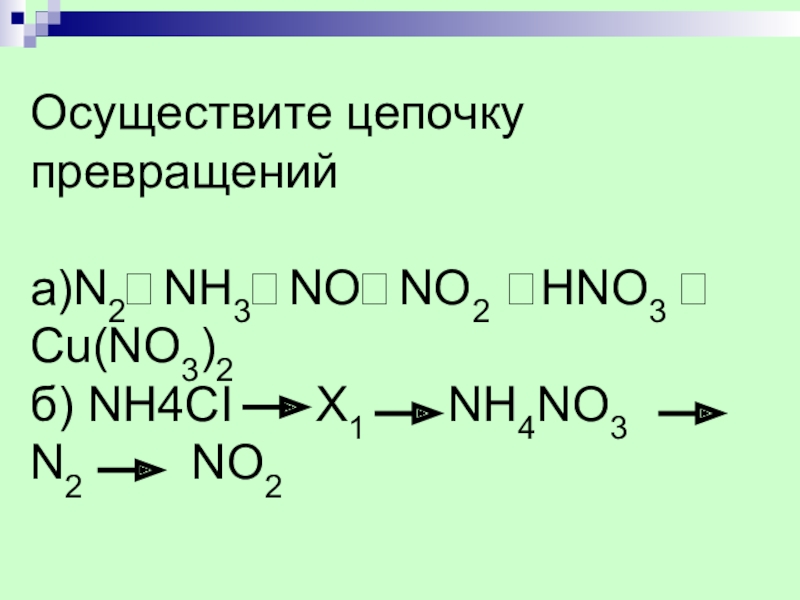
- 42. Осуществите цепочку превращений а)N2⭢NH3⭢NO⭢NO2 ⭢HNO3 ⭢
- 43. ЗАДАЧА Сколько литров нитрата аммония
- 44. В атмосфере бурого газа А сгорает
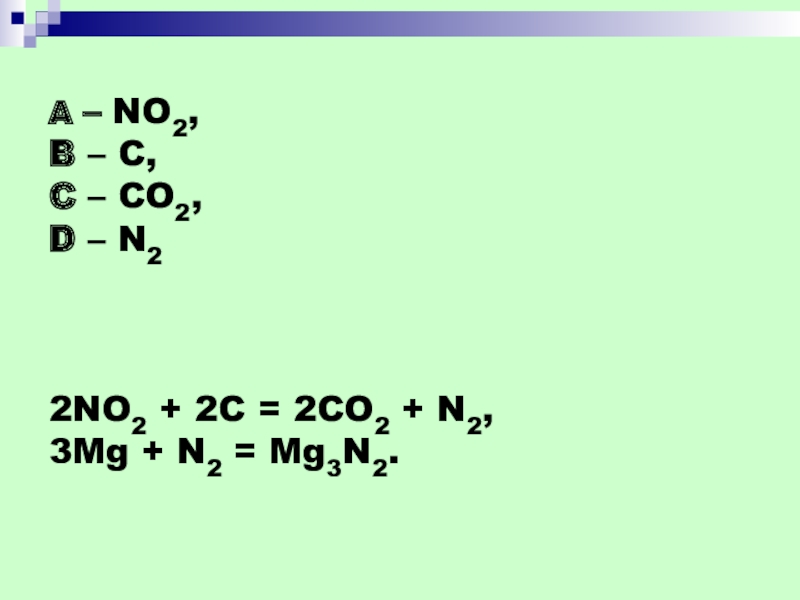
- 45. A – NO2, B – C, C
- 46. Выберите один правильный вариант ответа 1.Электронная формула атома азота:а)2S2 2P6б)2S22P3в)3 S23P3Г) 2S2 2P5
- 47. 2.Степень окисления -3 азот проявляет в соединении: а) NH3 б) NO в) НNO3 г) NaNO2
- 48. 3.Коэффициент перед формулой окислителя в уравнении
- 49. 4. аммиак в промышленности получают…
- 50. 5.Бурый газ, дающий при растворении в воде
- 51. 6.Азотная кислота может взаимодействовать с каждым
- 52. 7. Концентрированная азотная кислоты реагирует с медью
- 53. 8. Коэффициент перед формулой соли в уравнении
Слайд 2ЦЕЛЬ:
ПОВТОРЕНИЕ И УГЛУБЛЕНИЕ ЗНАНИЙ О ХИМИЧЕСКИХ И БИОЛОГИЧЕСКИХ СВОЙСТВАХ АЗОТА И
Слайд 4«НЕТ ЖИЗНИ БЕЗ АЗОТА, ИБО ОН ЯВЛЯЕТСЯ ВАЖНЕЙШЕЙ СОСТАВЛЯЮЩЕЙ ЧАСТЬЮ БЕЛКОВОЙ
Слайд 5История открытия азота. Нахождение в природе.
Азот. Свойства. Получение. Применение
Аммиак. Получение. Свойства.
Значение аммиака в медицине
Роль азота в живых организмах. Круговорот азота в природе
Оксиды азота. Свойства.
Свойства азотной кислоты и ее значение.
Соли соединений азота.
Слайд 6ИСТОРИЯ ОТКРЫТИЯ АЗОТА
В 1772 году английский химик
Генри Кавендиш - - «удушливый
В 1772 году шотландский химик,
ботаник и врач Даниел Резерфорд –
- «ядовитый воздух»
Слайд 7В 1773 году шведский химик-
аптекарь Карл Шееле –
«испорченный воздух»
В 1776
Антуан Лавуазье –
- «безжизненный воздух»
Слайд 8Нахождение в природе
Азот – один из распространенных элементов на Земле:
в атмосфере
( в состав воздуха)
- литосфере – 1,9•10-3 по массе
-в живых организмах - 0,3% по массе
-В белке животных и человека - 16–17% азота -
Слайд 13N2
Жидкий азот в медицине
Синтез аммиака
Синтез азотной кислоты
Производство
Создание инертной среды
Слайд 15Строение
Свойства физические
Молекулярная
кристаллическая
решетка
Легче воздуха
Хорошо растворим в воде
H2O
NH3
Слайд 18Применение
Получение
В промышленности
теплообменник
катализатор
турбокомпрессор
Смесь
азота и
водорода
холодильник
сепаратор NH3
Слайд 21РОЛЬ АЗОТА В ОРГАНИЗМЕ
БЕЛОК
НУКЛЕИНОВЫЕ КИСЛОТЫ
ГЕМОГЛОБИН
ГОРМОНЫ
Без азота → нет белка
Слайд 22АЗОТ В ЖИЗНИ РАСТЕНИЙ
замедляется рост растения
образование хлорофилла
бледно-зеленая окраска листьев
стебли становятся
цветки, не раскрываясь, засыхают и опадают
Слайд 25Молекула линейна
Бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворим
При 700 С разлагается: 2N2O= 2N2 + O2
+1
N2O
несолеобразующий
Слайд 26Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота
N2 + O2 ? 2NO
В лаборатории: Сu + HNO3 == Cu(NO3)2 + NO + H2O
+2
NO
несолеобразующий
Слайд 27Кислотный оксид:
N2O3 + H2O = 2HNO2
N2O3 + 2 KOH = 2
жидкость, темно – синего цвета, неустойчива при низких температурах и разлагается: N2O3 = NO + NO2
+3
N2O3
Слайд 28Кислотный оксид:
«Лисий хвост» Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
+4
NO2
токсичен
2NO2 + H2O = HNO2 + HNO3
Слайд 29Кислотный оксид:
N2O5 + H2O == 2HNO3
Легко разлагается (при нагревании –
2N2O5 == 4NO2 + O2
Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты : N2O5 + H2O == 2HNO3
Нестойкие кристаллы: 2N2O5 ==4NO2 + O2
+5
N2O5
Слайд 30«Азотная кислота»
По основности:
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По стабильности:
нестабильная
По летучести:
летучая
По степени диссоциации:
сильная
Слайд 31Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип
НNO3 (конц., дымящая)
ω = 1, желтая
НNO3 (разб., недымящая)
ω = 0, бесцветная
«Дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана
Правила обращения с концентрированной азотной кислотой
Работать в резиновых перчатках!
Берегись ожога!
При попадании кислоты на кожу место поражения быстро промыть большим количеством воды!
Слайд 32Химические свойства
«Азотная кислота по характеру среди своих подруг -
НNO3 ?
H+ + NO3-
НNO3 + лакмус фиолетовый =
Красный
Слайд 33С основаниями (нерастворимыми):
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
С растворимыми основаниями
NaOH + HNO3 = NaNO3+ H2O
С
CuO + 2HNO3 = Cu(NO3)2 + H2O
C солями (более слабых кислот):
Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O
Слайд 34HNO3
разбавленная
концентрированная
щелочные и
щелочно-земельные
Fe, Su
тяжелые
металлы
щелочные и
щелочно-земельные
тяжелые
металлы
NO2
Fe
Cr
Au
Al
Pt
пассивирует
не взаимодей-
ствует
N2O
NO
NH4NO3
NH3
Слайд 35Азотная кислота взаимодействует со многими неметаллами,
окисляя их до соответствующих кислот:
C + 4HNO3 = CO2 + H2O + 4NO2
Слайд 37
СОЛИ СОЕДИНЕНИЙ АЗОТА
Селитры – соли азотной кислоты и щелочных металлов.
NaNO3
КNO3 – калиевая селитра
Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды.
Слайд 38При нагревании нитраты разлагаются
с выделением кислорода (O2)
MeNO3
до Mg
MeNO3 MeO + NO2 + O2
MeNO3 Me + NO2 + O2
от Mg до Pb
после Cu
Слайд 39соли аммония - взаимодействии аммиака или
его водных растворов
с кислотами
NH3
NH4NO3
(аммиачная) селитра
аммония сульфат, сернокислый аммоний
(NH4)2SO4
Слайд 401.БЕСЦВЕТНЫЙ ГАЗ
2.ТЕМНО -СИНЯЯ ЖИДКОСТЬ
3.БУРЫЙ
4.ВЕСЕЛЯЩИЙ ГАЗ
5.БЕЛОЕ ТВЕРДОЕ ВЕЩЕСТВО
6.СЛАБЫЙ НАРКОТИК
7.АНГИДРИДАЗОТИСТОЙ И АЗОТНОЙ КИСЛОТ
8.НЕСОЛЕОБРАЗУЮЩИЙ ОКСИД
9. ЛЕГКО ОКИСЛЯЕТСЯ ВОЗДУХОМ
10.СОЛЕОБРАЗУЮЩИЙ ОКСИД